中图分类号:S188 文献标志码:A 文章编号:1001-4330(2025)01-0401-11
【结果】4种土壤中的全氮、全钾、有机碳和易氧化有机碳都无显著差异,而多个树种共生林内的全磷含量显著高于其他样地内土壤全磷的含量。(2)4种土壤中细菌的OTU数显著高于真菌,新疆野杏优势林的土壤细菌、真菌丰度最高,草地的土壤细菌、真菌丰度最低。新疆野苹果优势林内土壤细菌共鉴定出30门76 纲135目185科233属,土壤真菌共鉴定出7门20纲40目70科90属;新疆野杏优势林内土壤细菌共鉴定出31门78纲141目183科220属,土壤真菌8门17纲35目69科94属;多个树种共生林内土壤细菌共鉴定出29门75纲137目179科221属,土壤真菌共鉴定出7门15纲31目53科72属;林中草地内土壤共鉴定出28门72纲126目162科201属,土壤真菌共鉴定出5门13纲35目61科84属。(3)门分类水平的细菌群落中,优势菌为放线菌门、酸杆菌门和变形菌门,在真菌群落中优势菌为子囊菌门、被孢霉门和担子菌门;属分类水平下,优势细菌属为RB41属和 Rokubacteriales属,优势真菌属为 Humicola属、被孢霉属和 Linnemannia属。【结论】新疆野果林不同植被下土壤细菌群落多样性存在差异,林地的土壤微生物种类最丰富,而草地的土壤微生物种类较为贫乏。
0 引言
【研究意义】在生态系统中,土壤微生物是植物-土壤反馈的主导驱动因子[1-3],植物可通过凋落物和根系分泌物改变土壤环境,使得土壤微生物群落发生变化,而土壤环境和微生物群落的改变又影响植物的生长和健康[4-5],植物与土壤微生物之间存在紧密联系,不同的植物可能倾向于选择特定的土壤微生物群落,并调控着微生物的多样性及数量,土壤微生物优势种群及丰度也会因植物群落的不同而产生差异[6-7]。因此,研究不同植物下土壤微生物多样性的变化,有助于更好地理解生态系统中的相互关系,尤其是树种选择及其对土壤生态系统的生态学和环境管理有重要意义。【前人研究进展】Waid的研究分析了植被类型和数量对生态系统的重要影响,包括林下凋落物和根系分泌物的差异,以及土壤微生物群落的变化。伍思宇等9研究发现,在不同树种林下套种金花茶,其土壤微生物也不相同。刘炜璇等[\"研究发现,在不同植物群落下土壤微生物的群落结构存在差异性,土壤微生物组成与土壤理化性质存在相关性。曾全超[1研究发现,土壤微生物在黄土高原不同植被生态系统中呈现差异性,土壤细菌在草原植被下最为丰富,在森林植被下区最小。每种树种均与一组特定的微生物互动,从而形成树种特有的土壤微生物群落,这些互动可以直接或间接地影响土壤生态系统的多个方面,包括养分循环、有机物降解和土壤健康。在不同的植被内植物通过凋落物和根系对土壤微生物群落结构和多样性产生影响,而土壤微生物多样性又能影响有机质分解,养分释放和土壤结构的形成,对植物养分吸收和生长产生影响[12。不同植被中土壤微生物多样性对于王壤生态系统的稳定性和功能具有深远影响,土壤微生物多样性直接影响土壤生态系统的健康和功能[13-14]。甚至较高的微生物多样性通常与更高的生态系统稳定性和生产力相关联,因为微生物能够更好地适应环境变化,提高养分利用效率[15]。因此,土壤微生物多样性及其群落结构组成是评价其所在生态系统健康稳定的重要指标之一[16]。【本研究切人点】新疆巩留县野果林主要由新疆野苹果(Malussieversii)新疆野杏(Armeniacavulgaris)等野生果树植物资源组成,这种多样性使得巩留野果林成为理想的研究场所,目前有关野果林的研究大多集中于物种多样性,而有关巩留野果林土壤微生物多样性的研究尚少。【拟解决的关键问题】研究新疆巩留县野果林不同植被土壤微生物,分析不同植被土壤微生物多样性的特点,深入了解这一生态系统内微生物群落的组成、结构和功能,揭示野果林中的土壤微生物多样性的复杂性和重要性,为生态系统管理和保护提供科学依据。
材料与方法
1.1材料
新疆巩留县野果林地处伊犁河谷中东部,天山支脉那拉提山北麓( 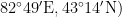 ,海拔1 2 0 0 ~ 1 3 5 0 m ,年降水量 2 7 0 ~ 2 8 0 m m ,属于北温带大陆性半干旱气候类型,年均气温
,海拔1 2 0 0 ~ 1 3 5 0 m ,年降水量 2 7 0 ~ 2 8 0 m m ,属于北温带大陆性半干旱气候类型,年均气温 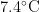 。土壤类型主要是山地黑棕色野果林土类,主要乔木树种有新疆野苹果(Malussieversii)、新疆野杏(Armeniacavulgaris)野i楂(Crataeguscuneata)等,灌木树种有黑果小檗(Berberisatrocarpa)、小叶忍冬(Loniceramicrophylla)、疏花蔷薇(Rosalaxa)等,草本有车轴草(Trifoliumcampestre)、稗草(Echinochloacrusgalli)、灰绿藜(Chenopodiumglaucum)鸭茅(Dactylisglomerata)等。
。土壤类型主要是山地黑棕色野果林土类,主要乔木树种有新疆野苹果(Malussieversii)、新疆野杏(Armeniacavulgaris)野i楂(Crataeguscuneata)等,灌木树种有黑果小檗(Berberisatrocarpa)、小叶忍冬(Loniceramicrophylla)、疏花蔷薇(Rosalaxa)等,草本有车轴草(Trifoliumcampestre)、稗草(Echinochloacrusgalli)、灰绿藜(Chenopodiumglaucum)鸭茅(Dactylisglomerata)等。
1.2 方法
1. 2. 1 试验设计
2023年5月,在新疆巩留县野果林试验地中,选择环境条件相似的 5 0 m× 5 0 m 新疆野苹果优势林(M)、新疆野香优势林(A)、多个树种共生林(H)林中草地(CK)作为样地,将草地作为对照。在每个样地随机设置3个 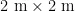 的样方,移开表面凋落物后,使用土壤采样环刀按5点取样法采样,采集 0 ~ 2 0 c m 土层的土壤样品混匀后装入已除菌的自封袋中标记为 M , A , H , C K ,带回实验室。混匀后的土壤过
的样方,移开表面凋落物后,使用土壤采样环刀按5点取样法采样,采集 0 ~ 2 0 c m 土层的土壤样品混匀后装入已除菌的自封袋中标记为 M , A , H , C K ,带回实验室。混匀后的土壤过 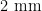 的筛以去除植物残体和大块石头,贮存于已除菌的自封袋中,分为两部分,一部分用于土壤基本理化性质测定,另一部分置于冰箱内 - 8 0 % 保存,用于土壤微生物检测。表1
的筛以去除植物残体和大块石头,贮存于已除菌的自封袋中,分为两部分,一部分用于土壤基本理化性质测定,另一部分置于冰箱内 - 8 0 % 保存,用于土壤微生物检测。表1
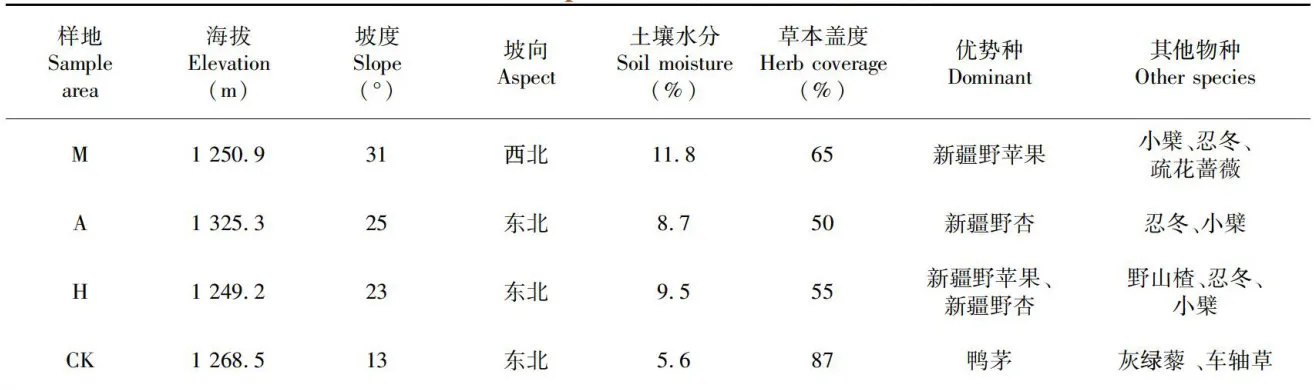 表1 不同样地的基本参数注:M:新疆野苹果优势林;A:新疆野杏优势林;H:多个树种共生林;CK:林中草地,下同 Notes:MMaluseesidoinantforest;AArmeiculgrisdoantforest;Hsmbioticforestofultiplespeies;CKforsaand,the same asbelow
表1 不同样地的基本参数注:M:新疆野苹果优势林;A:新疆野杏优势林;H:多个树种共生林;CK:林中草地,下同 Notes:MMaluseesidoinantforest;AArmeiculgrisdoantforest;Hsmbioticforestofultiplespeies;CKforsaand,the same asbelow1. 2.2 测定指标
1. 2.2.1 土壤理化性质
土壤全氮采用凯氏定氮法测定[17],土壤全磷含量采用钼锑抗比色法测定[17],全钾采用火焰光度法测定[18],土壤有机碳采用重铬酸钾氧化-外加热法测定[1],活性有机碳采用重铬酸钾-硫酸法测定[19] 。
1.2.2. 2 土壤微生物
采用高通量测序法测定土壤中的真菌、细菌的群落结构。
按照DNA试剂盒(生工生物工程(上海)股份有限公司)的操作说明,从冷冻的土壤样品中提取基因组DNA,之后进行PCR扩增和反应。检测土壤细菌的引物:16SrRNAV3-V4区域的341F( 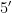 -CCTACGGGRBGCASCAG
-CCTACGGGRBGCASCAG 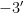 )和806R(
)和806R( 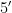 - GGACTACNNGGGTATCTAAT
- GGACTACNNGGGTATCTAAT  )进行PCR 扩增[20]。检测土壤真菌的引物:ITS1 区域的ITS5- 1737F(
)进行PCR 扩增[20]。检测土壤真菌的引物:ITS1 区域的ITS5- 1737F( 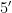 - GGAAGTAAAAGTCGTAA-
- GGAAGTAAAAGTCGTAA-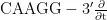 和ITS2-2043(
和ITS2-2043( 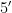 -GCTGCGTTCT-TC ATCGATGC -3)进行 PCR 扩增[21] 。
-GCTGCGTTCT-TC ATCGATGC -3)进行 PCR 扩增[21] 。
PCR反应体系为[22]: 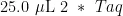 PCR
PCR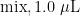 Primer F( 1 0 μ M ) 1 . 0 μ L Primer FR( 1 0 μ M ), 2 . 5 μ L gDNA,8. 0 μ L (204号
Primer F( 1 0 μ M ) 1 . 0 μ L Primer FR( 1 0 μ M ), 2 . 5 μ L gDNA,8. 0 μ L (204号 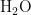 。PCR扩增程序为[22]:
。PCR扩增程序为[22]: 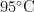 预变性
预变性 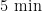
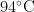 变性 1 m i n ,5 7 % 退火
变性 1 m i n ,5 7 % 退火 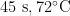 延伸
延伸 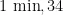 个循环,最后
个循环,最后
7 2 % 延伸 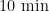 。使用NewEngland Biolabs公司的Phusion @ High-FidelityPCRMasterMixwithGCBuffer和高效高保真酶进行PCR扩增。PCR产物用 1 % 琼脂糖凝胶电泳检测DNA纯度和浓度,对目的条带使用胶回收试剂盒(ThermoScien-tific公司)回收产物。将PCR扩增纯化后的产物送至上海派森诺生物科技股份有限公司进行IIlu-mina-MiSeq高通量测序。
。使用NewEngland Biolabs公司的Phusion @ High-FidelityPCRMasterMixwithGCBuffer和高效高保真酶进行PCR扩增。PCR产物用 1 % 琼脂糖凝胶电泳检测DNA纯度和浓度,对目的条带使用胶回收试剂盒(ThermoScien-tific公司)回收产物。将PCR扩增纯化后的产物送至上海派森诺生物科技股份有限公司进行IIlu-mina-MiSeq高通量测序。
1.3 数据处理
使用Uparse软件对所有土壤样品的全部有效数据在 9 7 % 相似度水平下进行聚类,获得Op-erationalTaxonomieUnits(OTU),根据OTU聚类结果对每个OTU的序列做物种注释,得到对应的物种信息和丰度信息[23]。绘制稀疏曲线来探究样品数据是否合理,通过Venn图、  多样性指数和物种群落组成堆积图分析土壤微生物多样性和微生物群落结构组成。
多样性指数和物种群落组成堆积图分析土壤微生物多样性和微生物群落结构组成。
2 结果与分析
2.1 不同植被下土壤理化性质
研究表明,全氮、全钾、有机碳和易氧化有机碳在新疆野苹果优势林、新疆野杏优势林、多个树种共生林和林中草地均无显著差异,全磷含量表现出差异性,在多个树种共生林地内显著高于其他样地。表2
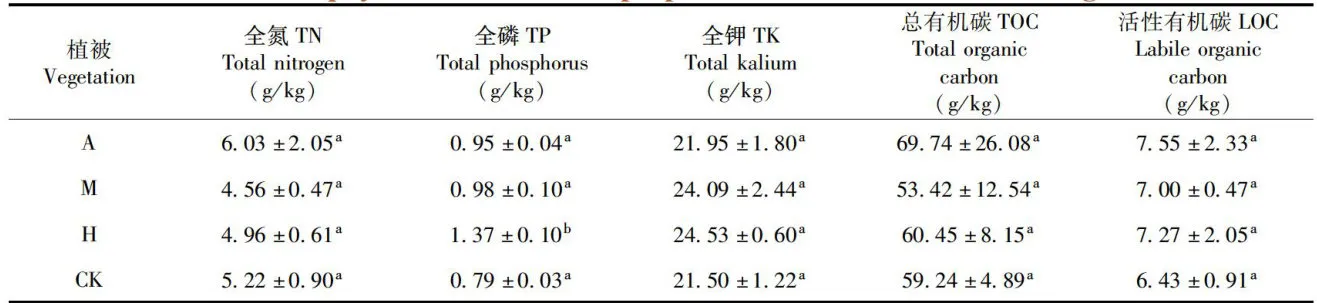 表2 不同植被下土壤的基本理化性质Tab.2 Basic physical and chemical properties of soil under different vegetation注:不同小写字母表示显著差异(
表2 不同植被下土壤的基本理化性质Tab.2 Basic physical and chemical properties of soil under different vegetation注:不同小写字母表示显著差异( 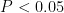 ,下同Notes:Different lowercasesindicate significantdifferences(
,下同Notes:Different lowercasesindicate significantdifferences( 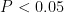 ),thesameasbelow
),thesameasbelow2.2 不同植被下土壤微生物测序
研究表明,不同植被凋落物下土壤细菌和土壤真菌的稀释曲线最终趋于平坦,试验测序的数据可以反映土壤细菌和土壤真菌群落组成情况。且细菌OTU数范围为 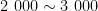 ,真菌OTU数范围为 1 5 0 ~ 2 5 0 ,细菌的OTU数高于真菌OTU数。图1
,真菌OTU数范围为 1 5 0 ~ 2 5 0 ,细菌的OTU数高于真菌OTU数。图1
共检测到土壤细菌OTUs数为15704个,不同植被下土壤细菌所共有的OTUs个数有361个,占所有样品细菌OTUs总数的 2 . 3 0 % ,新疆野杏优势林、新疆野苹果优势林、多个树种共生林和林中草地分别有 2 3 8 5 , 2 0 8 0 , 2 3 3 6 和2299个特有OTUs,分别占所有样品OTUs总数的 1 5 . 1 9 % !1 3 . 2 5 % . 1 4 . 8 8 % 和 1 4 . 6 1 % ,其中新疆野杏优势林特有OTUs数最多,新疆野苹果优势林特有OTUs数最少;共检测到土壤真菌OTUs数为1533个,不同植被下土壤真菌所共有的OTUs个数有33个,占所有样品真菌OTUs总数的 2 . 1 5 % ,新疆野杏优势林、新疆野苹果优势林、多个树种共生林和林中草地分别有279、276、222和248个特有
OTUs,分别占所有样品真菌OTUs总数的1 8 . 2 0 % . 1 8 . 0 0 % 、 . 1 4 . 4 8 % 和16. 1 8 % ,其中新疆野杏优势林特有OTUs数最多,多个树种共生林特有OTUs数最少。图2
图1 不同植被下土壤微生物的稀疏曲线
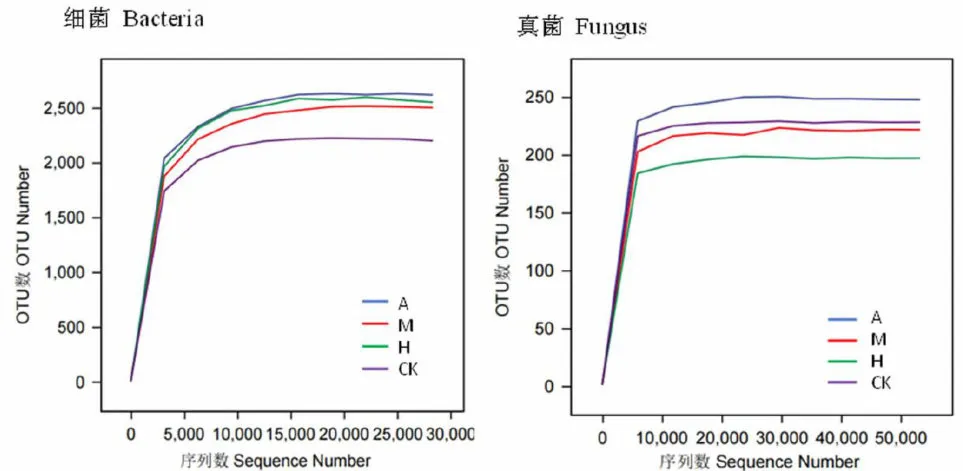
注:A:野杏优势林;M:新疆野苹果优势林;H:多个树种共生林地;CK:林中草地,下同Notes:A:Armencagarisdointforst;:Malussieversionanforest;sbiotiostofuliplepecis;CKta-land,the same as below
Fig.1 Sparsecurveofsoilmicroorganismsunderdifferentvegetation
注: 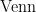 图中每个色块代表一个样本,色块间的重叠区域指示相应样本间所共有的OTUs数目,没有重叠部分的数字代表样本特有的OTUs个数
图中每个色块代表一个样本,色块间的重叠区域指示相应样本间所共有的OTUs数目,没有重叠部分的数字代表样本特有的OTUs个数
 图2 不同植被下基于土壤微生物OTUs的Venn图Fig.2Venn diagram based on soil microbial OTUsunder different vegetation
图2 不同植被下基于土壤微生物OTUs的Venn图Fig.2Venn diagram based on soil microbial OTUsunder different vegetationNotes:IntheVenfigure,achcolorblockrepresntsasample,andtheoverlappngareabetweethecolorbocksindicatestheumberof OTUssharedamong thecorespondingsamples,whiletheumberwitoutoverlappngpartrepresents theumberofOUsuiquetotheaple
2.3 不同植被下土壤微生物群落结构组成
2.3.1 不同植被下土壤微生物物种分类
研究表明,新疆野杏优势林土壤细菌共鉴定 出31门78纲141目183科220属,土壤真菌8门 17纲35目69科94属;新疆野苹果优势林土壤细 菌共鉴定出30门76纲135目185科233属,土 壤真菌共鉴定出7门20纲40目70科90属;多 个树种共生林土壤细菌共鉴定出29门75纲137 目179科221属,土壤真菌共鉴定出7门15纲31 目53科72属;林中草地土壤细菌共鉴定出28门 72纲126目162科201属,土壤真菌共鉴定出5 门13纲35目61科84属;新疆野香优势林的土 壤细菌、真菌种类较高,草地的土壤细菌、真菌种 类较低。表3
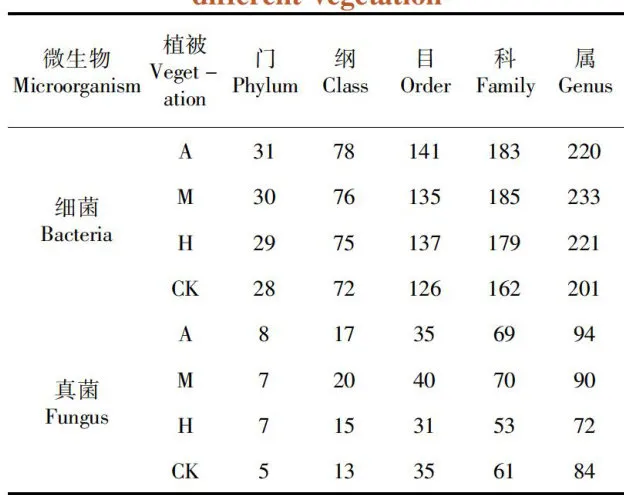 表3不同植被下土壤微生物物种分类统计Tab.3 Classification statistics of species ofsoilmicroorganismsunder
表3不同植被下土壤微生物物种分类统计Tab.3 Classification statistics of species ofsoilmicroorganismsunder2.3.2土壤细菌群落结构组成
研究表明,在门分类水平上,展示相对丰度最高的10种,其他归为others。在4种土壤中优势细菌类群为放线菌门Actinobacteriota、酸杆菌门Acidobacteriota和变形菌门Proteobacteria,合计占比在 70 % 左右。其中放线菌门在草地土壤中相对丰度最高,占比 3 0 . 6 9 % ,其次为新疆野香优势林土壤,相对丰度占比为 2 9 . 9 7 % ,在新疆野苹果优势林土壤中相对丰度占比为 2 1 . 0 8 % ,在多个树种共生林土壤中相对丰度最低,占比 2 0 . 5 8 % ;酸杆菌门和变形菌门在多个树种共生林土壤中相对丰度最高,占比分别为 2 4 . 2 6 % . 2 2 . 2 8 % ,在新疆野苹果优势林土壤中相对丰度占比分别为2 3 . 2 3 % 21.46%,在新疆野杏优势林土壤中相对丰度占比分别为 2 0 . 4 3 % . 2 1 . 0 9 % ,在草地土壤中相对丰度最低,占比分别为 1 7 . 7 8 % ) 1 7 . 8 9 % 。图3
在属分类水平上,4种土壤中群落相对丰度前30的细菌占总细菌群落 5 0 . 2 1 % 以上,Others相对丰度占属水平细菌群落的 4 7 . 9 5 % 14 9 . 7 9 % 。其中, R B 4 1 属和Rokubacteriales属为优势细菌群落(相对丰度 gt; 4 % )。 R B 4 1 属在新疆野苹果优势林土壤中相对丰度最高,为 8 . 2 1 % ,在草地土壤中相对丰度最低,为 5 . 3 8 % ;Rokubac-teriales属在草地土壤中相对丰度最高,为6 . 3 9 % ,在新疆野杏优势林土壤中相对丰度最低,为 4 . 1 7 % 。图4
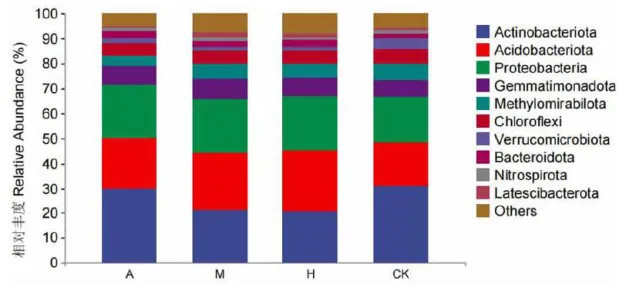 图3门分类水平上不同植被下土壤细菌群落组成Fig.3 Soilbacterial communitycomposition underdifferentvegetationatthe phylumclassificationlevel
图3门分类水平上不同植被下土壤细菌群落组成Fig.3 Soilbacterial communitycomposition underdifferentvegetationatthe phylumclassificationlevel2.3.3 土壤真菌群落结构组成
研究表明,在门分类水平上,在4种土壤中优势真菌类群为子囊菌门Ascomycota、被孢霉门Mortierellomycota和担子菌门Basidiomycota,相对丰度占比合计在 80 % 以上。其中子囊菌门在新疆野杏优势林、新疆野苹果优势林、多个树种共生林和草地土壤中的相对丰度最高,占比分别为7 9 . 6 4 % (204号 . 7 4 . 8 6 % , 6 9 . 9 8 % 和 5 2 . 1 6 % ;被孢霉门在新疆野杏优势林、新疆野苹果优势林、多个树种共生林和草地土壤中的相对丰度占比分别为1 5 . 7 8 % 、11. 32 % (20 , 1 1 . 9 9 % 和 4 0 . 5 8 % ;担子菌门在新疆野杏优势林、新疆野苹果优势林、多个树种共生林和草地土壤中的相对丰度占比分别为4 . 2 3 % 5.88% 1 5 . 8 9 % 和 3 . 2 2 % 。子囊菌门在新疆野杏优势林土壤中相对丰度最高,在草地土壤中相对丰度最低;被孢霉门在草地土壤中相对丰度显著高于其他植被的土壤,在新疆野苹果优势林土壤中相对丰度最低;担子菌门在多个树种共生林地土壤中的相对丰度显著高于其他植被的土壤,在草地土壤中相对丰度最低。图5
在属分类水平上,4种土壤中群落相对丰度前30的真菌占总真菌群落 5 0 . 6 7 % 以上,Others相对丰度占属水平细菌群落的 3 3 . 4 3 % \~4 9 . 3 3 % 。其中,Humicola属、被孢霉属Mortierella和Linnemannia属为优势真菌类群(相对丰度 gt; 4 % )。Humicola属在新疆野苹果优势林土壤中相对丰度最高,为 1 4 . 1 7 % ,在草地土壤中相对丰度最低为 8 . 2 7 % ;被孢霉属在草地土壤中相对丰度显著高于其他植被土壤,为 1 2 . 8 6 % ,在新疆野苹果优势林土壤中最低,为 3 . 7 6 % ;Linnemannia属在草地土壤中最高,为 6 . 2 7 % ,在新疆野苹果优势林土壤中最低,为 4 . 6 1 % 。图6
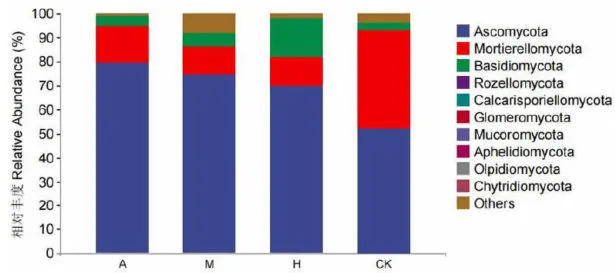 图5 门分类水平上不同植被下土壤真菌群落组成"
图5 门分类水平上不同植被下土壤真菌群落组成"2.4 不同植被下土壤微生物多样性
2.4.1 Alpha多样性
研究表明,新疆野苹果优势林、新疆野杏优势林和多个树种共生林的土壤中细菌Chao1指数、Shanoon指数和Simpson指数均显著高于草地土壤,草地土壤细菌丰富度和多样性无其他3种土壤中细菌丰富度和多样性高。4种土壤样品中真菌Chao1指数无明显显著差异,4种土壤中王壤真菌丰富度差异不大,Shanoon指数在4种土壤中真菌多样性存在差异,新疆野杏优势林土壤显著高于草地土壤,而Simpson指数在4种土壤样品中无明显显著差异,新疆野杏优势林的土壤真菌多样性最高,草地土壤真菌多样性最低。表4
2.4.2 Beta多样性
研究表明,新疆野苹果优势林和多个树种共生林的土壤样品中细菌物种组成相似,新疆野杏优势林和多个树种共生林的土壤样品中真菌结构相差不大,而草地与其他3种土壤样品的微生物构成差距较大。点与点之间距离的远近代表样品中群落的差异程度。图7
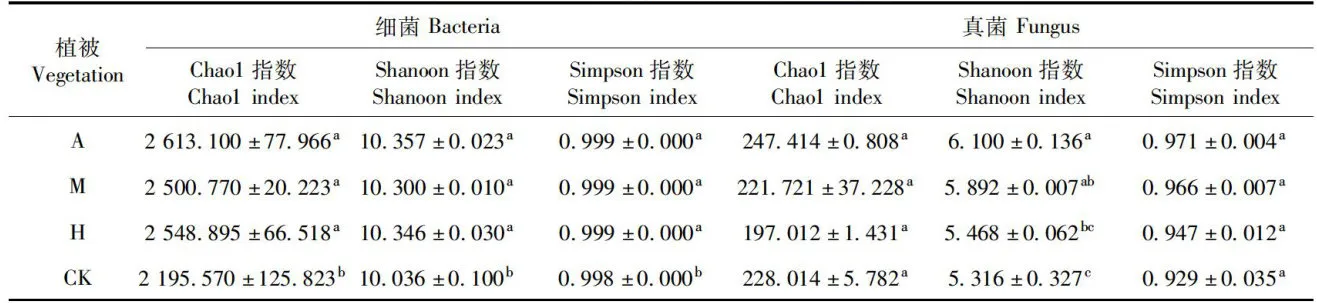 表4Alpha多样性分析
表4Alpha多样性分析注:第1主成分轴(PCo1)和第2主成分轴(PCo2)表示2个选定的主坐标轴,坐标轴括号中的百分比代表了对应的坐标轴所能解释的样本差异数据的比例;PCol轴和PCo2轴的刻度是相对距离,无实际意义;不同颜色的点代表不同的样本,2样本点越接近,2样本的物种组成越相似
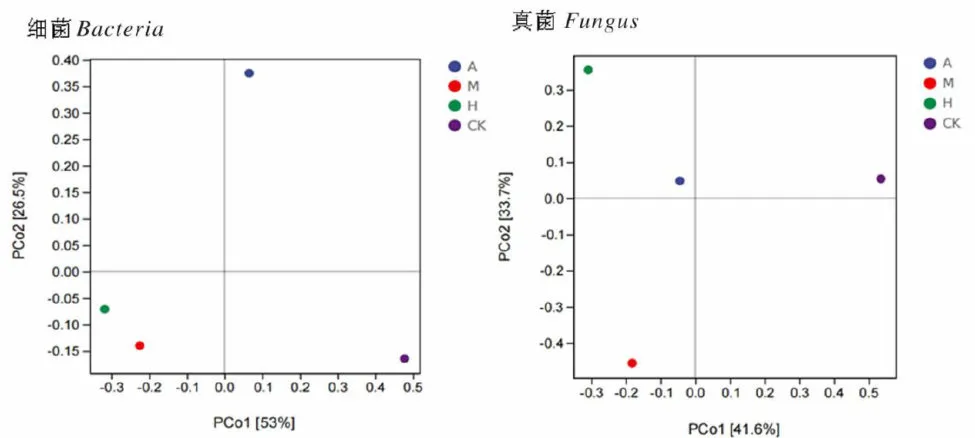 图7 细菌和真菌PCoA分析图(OTUlevel)
图7 细菌和真菌PCoA分析图(OTUlevel)3讨论
3.1土壤微生物参与养分循环、有机物质降解、植物健康和生态系统的稳定性等多个重要生态过程[24]。研究基于高通量测序技术,对新疆野苹果优势林、新疆野杏优势林、多个树种共生林和林中草地的土壤微生物多样性进行研究,通过测序分析发现在土壤中细菌的OTU数明显高于真菌,表明细菌在环境资源丰富的情况下呈更高的丰度和多样性,可能是由于野果林植物的根系分泌物对细菌有利,促进细菌数量增加,对真菌有抑制作用[25-26]。物种分类统计和Venn 图的结果表明,在同一生态系统下,不同植被的土壤微生物群落具有一定的共性和特异性[27],新疆野杏优势林的土壤微生物种类最丰富,而草地的土壤微生物种类较低,这可能与土壤性质和植被类型有关[28],野杏是深根性物种,根系发达,产生根系分泌物吸引土壤微生物,与土壤微生物之间的相互作用增强。细菌和真菌的特有OTU数量在不同样地之间存在差异,不同土壤中的微生物群落结构存在一定的差异。
3.2通过对新疆野苹果优势林、新疆野杏优势林、多个树种共生林和林中草地的土壤微生物群落结构组成分析结果表明,在门分类水平上,放线菌门、酸杆菌门和变形菌门为优势细菌类群,在4种土壤中种类和丰度无显著差异。变形菌门和放线菌门的丰度增加有助于土壤中物质的降解,从而增强土壤的环境稳定性[29-30],促进土壤养分的增加。酸杆菌是一种寡养细菌,适合在营养较低的土壤环境中分布[31],在植物残体分解中起重要作用。在真菌群落中子囊菌门、被孢霉门和担子菌门为优势类群,真菌的优势菌种类无差异,但其丰度却表现出了显著差异。子囊菌门和担子菌门在新疆野苹果优势林、新疆野杏优势林和多个树种共生林土壤中丰度比在草地土壤中高,被孢霉门与其相反,在草地土壤中丰度更高,由此可知子囊菌门和担子菌门大多存在于林地土壤中,而被孢霉门多存在于草地土壤。可能与不同植被类型有关[32],林地植被主要为乔木,还包括灌木和草本,植被丰富;而草地植被较为单一。子囊菌门大多为腐生菌可降解一些难以降解的物质[33-34],担子菌门能降解木质素等物质,在木质素含量较高的植被中广泛存在[35],子囊菌门和担子菌门的菌根真菌和植物的根系互惠共生,促进植物对养分的吸收,提高植物抗性。相对于草地,林地的木质素含量更高,植物种类多,所能产生的凋落物和根系分泌物更多,更有利于菌根真菌的生存,子囊菌门和担子菌门也就更丰富。在细菌类群下的RB41属Rokubacteriales属和真菌类群下的Humi-cola属、被孢霉属、Linnemannia属等在4种土壤中优势,这些菌属在土壤中可增强土壤养分循环和提高植物抗逆性[36-37] 。
4结论
在不同植被土壤中细菌具有更高的丰度,相比于草地,林地的土壤微生物群落更为丰富,更适合微生物活动。在4种植被下土壤微生物群落组成差异明显,门分类水平的细菌群落中优势菌为放线菌门、酸杆菌门和变形菌门,在真菌群落中优势菌为子囊菌门、被孢霉门和担子菌门,在林地土壤中子囊菌门和担子菌门更为丰富,在草地土壤中被孢霉门更为丰富;这些菌在有机质降解、增强土壤养分循环和促进植物吸收方面起到重要作用。新疆野果林不同植被下土壤细菌群落多样性存在差异,林地的土壤微生物种类最丰富,而草地的土壤微生物种类较为匮乏。
参考文献(References)
[1]He ZM,Yu ZP,HuangZQ,et al.Liter decomposition,residuechemistryand microbial community structureundertwosubtropical forestplantations:areciprocal litter transplant study[J]. AppliedSoil Ecology,2016,101:84-92.
[2]巴音达拉.病原菌及菌根菌维持森林植物多样性机制的研 究进展[J].中国野生植物资源,2023,42(10):96-100. Bayindala.Advancesinmechanismsof pathogenicandmycorrhizal fungimaintenance on forest plant diversity[J].Chinese Wild PlantResources,2023,42(10):96-100.
[3]席念勋,张原野,周淑荣.群落生态学中的植物-土壤反馈 研究[J].植物生态学报,2023,47(2):170-182. XI Nianxun,ZHANG Yuanye,ZHOU Shurong. Plant - soil feedbacksin community ecology[J].Chinese Journal ofPlant Ecology,2023,47(2):170-182.
[4]Li Z L, Zeng Z Q, Song Z P, et al. Vital roles of soil microbes in driving terrestrial nitrogen immobilization[J]. Global Change Biology,2021,27(9): 1848-1858.
[5]QiJJ,FuDQ,WangXZ,et al.The effect of alfalfa cultivation on improving physicochemical properties soil microorganisms community structure of grey desert soil[J].Scientific Reports,2023, 13(1): 13747.
[6]Wardle DA. The influence of biotic interactions on soil biodiversity[J]. Ecology Letters,2006,9(7) : 870 -886.
[7]Pii Y,Mimmo T,TomasiN,et al.Microbial interactionsinthe rhizosphere:beneficial influences of plant growth -promoting rhizobacteria on nutrient acquisition process.A review[J].Biology andFertility of Soils,2015,51(4):403-415.
[8]Saville Waid J.Does soil biodiversity depend upon metabiotic activity and influences?[J].Applied Soil Ecology,1999,13(2): 151 -158.
[9]伍思宇,李宝财,李纪元,等.不同树种林下套种金花茶土 壤微生物多样性分析[J].广西林业科学,2021,50(2):115 -124. WU Siyu,LI Baocai,LI Jiyuan,etal.Soil microbial diversityof planting Camellia nitidissima under different tree species[J]. GuangxiForestryScience,2021,50(2):115-124.
[10]刘炜璇,李依蒙,江红星,等.吉林莫莫格国家级自然保护 区四种典型植物群落下土壤微生物组成的对比分析[J].生 态学杂志,2023. LIU Weixuan,LI Yimeng, JIANG Hongxing,et al. Comparative analysis of soil microbial composition of four typical vegetation communities in Momoge National Nature Reserve, Jilin Province [J]. Chinese Journal of Ecology,2023.
[11]曾全超.黄土高原不同植被生态系统土壤微生物多样性及 其影响因素研究[D].北京:中国科学院研究生院(教育部水 土保持与生态环境研究中心),2015. ZENG Quanchao. The soil factors affecting soil microbial under diferent vegetation ecozones on the Loess Plateau of China[D]. Beijing:Research Center for Eco-Environmental Sciences,Chinese Academy of Sciences,2015.
[12]程智超,杨立宾,隋心,等.黑龙江中央站黑嘴松鸡国家级 自然保护区不同森林类型土壤微生物功能多样性分析[J]. 环境科学研究,2021,34(5):1177-1186. CHENG Zhichao,YANG Libin,SUI Xin,et al. Soil microbial functional diversityresponses to diffrent revegetation types in Heilongjiang Zhongyangzhan black -billed capercaille nature reserve[J].Research of Environmental Sciences,2021,34(5): 1177 -1186.
[13] Saleem M,Hu J,Jousset A. More than the sum of its parts: microbiomebiodiversity asa driver of plant growth and soil health [J].Annual Review of Ecology,Evolution,and Systematics, 2019,50:145-168.
[14]张旋,杜薇,白立东,等.包头市劳动公园林下土壤微生物 多样性与功能研究[J].内蒙古农业大学学报(自然科学 版),2023,44(1):60-65. ZHANG Xuan,DU Wei,BAI Lidong,et al.Microbial diversity and function of understory soil in Baotou laborpark[J]. Journal of Inner Mongolia Agricultural University (Natural Science Edition),2023,44(1) : 60-65.
[15]孔亚丽,秦华,朱春权,等.土壤微生物影响土壤健康的作 用机制研究进展[J].土壤学报,2024,61(2):331-347. KONG Yali,QIN Hua,ZHU Chunquan,et al.Research progress on the mechanism by which soil microorganisms affect soil health[J]. Acta Pedologica Sinica,2024,61(2):331-347.
[16]刘会梅,张天宇.土壤真菌研究进展[J].山东农业大学学 报(自然科学版),2008,39(2):326-330. LIU Huimei, ZHANG Tianyu.Research progress onsoil fungi [J].Journal of Shandong Agricultural University (Natural Science Edition),2008,39(2):326-330.
[17]鲍士旦.土壤农化分析(3版.)[M].北京:中国农业出版 社,2000. BAO Shidan. Soil and agricultural chemistry analysis (3rd ed.) [M].Beijing:China Agriculture Press,000.
[18]Chen YF, Ye JR,Kong QQ. Potassium-Solubilizing Activity of Bacillus aryabhattai SK1-7 andIts Growth - Promoting Effct onPopulusalbaL[J].Forests,2020,11(12):1348.
[19]周伟,吴红慧,张运龙,等.土壤活性有机碳测定方法的改 良[J].土壤通报,2019,50(1):70-75. ZHOU Wei,WU Honghui,ZHANG Yunlong,et al.Improvement of determination method for soil labile organic carbon[J]. Chinese Journal of Soil Science,2019,50(1):70-75.
[20]BergJ,BrandtKK,Al-SoudWA,etal.Selection forCutolerant bacterial communities with altered composition,but unaltered richness,via long-term Cu exposure[J].Applied and Environmental Microbiology,2012,78(20): 7438-7446.
[21]朱立月,丁美月,黄冠南,等.内蒙古通辽市砂质土壤中微 生物群落结构及其与环境因子的关系[J].科学技术与工程, 2018,18(20): 347-352. ZHU Liyue,DING Meiyue,HUANG Guannan,et al.Microbial community structure and the correlation between environmental factorsand community structure in sandy soil of Tongliao in Inner Mongolia[J].Science Technology and Engineering,2018,18 (20):347-352.
[22]董学德.麻栎-刺槐林凋落物分解过程中土壤微生物群落 变化特征及影响因素[D].泰安:山东农业大学,2021. DONG Xuede.Changing characteristics and influencing factors of the soil microbial community during litter decomposition in the Mixed Quercus acutissima Carruth and Robinia pseudoacacia L. Forest[D]. Taian: Shandong Agricultural University,2021.
[23] Stach JE M,Maldonado L A,Masson DG,et al. Statistical approaches for estimating actinobacterial diversity in marine sediments[J]. Aplied and Environmental Microbiology,2003,69 (10): 6189-6200.
[24]鲍佳书,汤玉洁,刘俊萍,等.不同品种薄壳山核桃林地土 壤微生物多样性及群落组成[J].中南林业科技大学学报, 2022,42(9):24-36. BAO Jiashu,TANG Yujie,LIU Junping,et al. Study on soil microbial diversity and community composition of different pecan plantations[J].Journal of Central South University of Forestryamp; Technology,2022,42(9): 24-36.
[25]陈新.季节性雪被下新疆天山雪岭云杉林凋落物分解与土 壤微生物的关系[D].乌鲁木齐:新疆大学,2019. CHEN Xin. Relationship between litter decompositionand soil microbes of Schrenk spruceinforest under seasonal snowfall in Tianshan Mountains,Xinjiang[D].Urumqi:Xinjiang University,2019.
[26]岳雪娇,黄沛,李永华,等.敦煌三道泉典型植物群落土壤 微生物群落结构特征与影响因素[J].陆地生态系统与保护 学报,2023(3):37-47. YUE Xuejiao,HUANG Pei,LI Yonghua,et al. Structural characteristics and influencing factors of soil microbial community in typical plant communities in Sandaoquan Region of Dunhuang [J].Terrestrial Ecosystem and Conservation,2023(3): 37-47.
[27]蔡冠霞,夏凡,李栋,等.不同土地利用类型下土壤微生物 群落结构特征的模拟试验研究[J].矿物岩石地球化学通报, 2022,41(5):1023 -1032. CAI Guanxia, XIA Fan,LI Dong,et al. A simulation studyon characteristics ofsoil microbial community structure under diferentland uses[J].Bulletinof Mineralogy,Petrology and Geochemistry,2022,41(5):1023-1032.
[28]张蓉,于亚军.煤矸山复垦林地和草地土壤微生物多样性 和群落组成的差异及其影响因素[J].生态学杂志,2018,37 (6) : 1662 -1668. ZHANG Rong,YU Yajun.Diferences of soil microbial diversity and community composition between reclaimed woodland and grassland in coal wastepileand their influencing factors[J].Chinese Journal of Ecology,2018,37(6):1662-1668.
[29]王改萍,阿依古丽·托乎提,王茹,等.新疆乌尔禾地区盐 渍土壤耐盐细菌多样性与群落结构研究[J].微生物学杂志, 2021,41(2):17-26. WANG Gaiping,AyiguliTuohuti,WANG Ru,et al.Diversity and community structure of salt -tolerant bacteria in salinized soil inWuerheareainXinjiang[J].Journal ofMicrobiology,2021, 41(2):17-26.
[30]王岳,丁国栋,刘梦婕,等.榆林沙区典型林地不同植被类 型对土壤微生物群落结构的影响[J].土壤通报,2022,53 (4) : 907 -918. WANG Yue,DING Guodong,LIU Mengjie,et al. Influence of diffrent vegetation types onsoil microbial characteristics of typical forest land in Yulinsandyarea[J].Chinese Journal of Soil Science,2022,53(4):907-918.
[31]熊冰杰,何舒,张澳,等.基于高通量测序技术的林下三七 土壤微生物多样性研究[J].山东农业科学,2023,55(8): 80 -87. XIONG Bingjie,HE Shu, ZHANG Ao,et al. Study on microbial diversity of Panax notoginseng rhizosphere soil in forest based on high-throughput sequencing[J].Shandong Agricultural Sciences,2023,55(8):80-87.
「32]工旦改△藏节戏笙阿欠寿组共坦际士拥微牛物夕 样性研究[J].广西植物,2023,43(8):1467-1477. WANGJing,ZHANGHuiping,SUXiao,etal.Microbial diversityinrhizospheresoilofAnemonealtaica[J].Guihaia,2023, 43(8):1467-1477.
[33]FreySD,KnorrM,ParrentJL,etal.Chronicnitrogenenrichment affects the structure and function of thesoil microbial community in temperate hardwood and pine forests[J]. ForestEcologyandManagement,2004,196(1):159-171.
[34]王诗慧,常顺利,李鑫,等.天山林区土壤真菌多样性及其 群落结构[J].生态学报,2021,41(1):124-134. WANGShihui,CHANGShunli,LIXin,etal.Soil fungal diversityand its community structure in Tianshan Forest[J].Acta EcologicaSinica,2021,41(1):124-134.
[35]陈秀波,朱德全,赵晨晨,等.不同林型红松林土壤真菌群 落组成和多样性[J].土壤学报,2019,56(5):1221-1234. CHENXiubo,ZHU Dequan,ZHAO Chenchen,etal.Communitycomposition and diversityof fungi in soils underdifferent types of Pinus horaiensis forests[J].Acta Pedologica Sinica, 2019,56(5):1221-1234.
[36]StoneBW,LiJH,KochBJ,et al. Nutrientscauseconsolidation of soil carbon flux to small proportion of bacterial community [J].NatureCommunications,2021,12(1):3381.
[37]杨虎,王佩瑶,李小伟,等.贺兰山东坡不同植被类型的土 壤真菌多样性及其群落结构[J].生态环境学报,2022,31 (2):239-247. YANGHu,WANGPeiyao,LIXiaowei,etal.Distributionof soilfungal diversity and community structure in different vegetation types on the eastern slopes of Helan Mountains[J]. Ecology andEnvironmental Sciences,2022,31(2):239-247.
Study on soil microbial diversity under different vegetation in Xinjiang wild fruit forests
LIU Xuebing1,Balejin²,Bian Bai³,Wulan Wushang1,Bayindala
(1. Colege of Forestry and Landscape Architecture, Xinjiang Agricultural University, Urumqi 830052, China; 2. Middle School of Unity Farm, the Ninth Agricultural Division, XPCC, Tacheng Xinjiang 834601, China;3. Agricultural Development Center of Shanghu Township, Emin County, Tacheng Xinjiang 834600, China)
Abstract:【Objective】To study soil microbial diversity under diffrent vegetation of Gongliu wild fruit forest.【Methods】Four diferent types of forest land with similar environmental conditions,namely Malus sieversii dominant forest,Armeniaca vulgaris dominant forest,multi-species symbiotic forest and forest grassland,were selected as sample sites.The soil physical and chemical properties of the four sample sites were collected and determined.Ilumina-MiSeq high-throughput sequencing technology was used to investigate the soil microbial diversity and community structure of the four sample sites.【Results】(1) There was no significant difference in total nitrogen,total potassium,organic carbon and easily oxidized organic carbon in the foursoils,and total phosphorus content in the symbiotic forest of multiple tree specieswas significantly higher than that in the other plots.(2)The OTU number of bacteria in the four soil species was significantly higher than that of fungi,and the abundance of bacteria and fungi in the soil in the dominant forest of Armeniaca vulgaris wasthe highest,while the abundance of bacteria and fungi in the soil of grassland was the lowest.The soil bacteria in the dominant forest of Malus sieversiidentified a total of3Ophylums,76 phylums,135orders, 185familiesand 233genera,and thesoil fungi identified a total of7 phylums,2O phylums,4Oorders,70 families and9O genera;thesoilbacteria in the dominant forest of Armeniaca vulgaris identified a total of 31 phylums,78 phylums,141orders,183 families and 22O genera,and the soil fungi identified a total of 8 phylums,17 phylums,35orders,69 families and94 genera;soil bacteria in the symbiotic forest of multiple species were identifiedas A total of 221 genera of soil bacteria and7 generaof soil fungi were identified in 29 phylums,75 phylums,137orders,179 families,and7 phylums,15orders,31 families,53families and 72 genera;a total of 201 genera of soil bacteria were identified in 28 phylums,72 phylums,126orders,162 families,and5phylums,13orders,35 families,61 familiesand84 genera of soil fungi were identified in soil of thegrassland in the forest.(3)In thebacterial communityatthephyla classification level,the dominant bacteria were Actinomycota,Acidobacteria and Proteobacteria,while in the fungal community,the dominant bacteria were ascomycetes,mortieromycota and basidiomycota.At the genus level,the dominant bacteria genera areRB41and Rokubacteriales,and the dominant fungi generaare Humicola,Mortierella and Linnemannia. 【Conclusion】There werediffrences in the diversityof soil bacterial communities under diferent vegetation in Gongliu wild fruit forest.The soil microbial species offorest land was the most abundant,whilethe soil microbial species of grassland was relatively poor.
Key words: wild fruit forest; soil microbial; high throughput sequencing; community structure