中图分类号:S43 文献标志码:A 文章编号:1001-4330(2025)02-0393-08
0 引言
【研究意义】欧洲甘蓝粉虱AleyrodesproletellaL.(简称 A p )是多食性农田和温室作物、蔬菜害虫,尤为嗜食十字花科和菊科植物,是欧洲十字花科蔬菜的主要害虫[1-2]。自20 世纪90 年代末以来,该粉虱在世界多个国家的芸苔类作物种植区迅速繁殖[3-6]。欧洲甘蓝粉虱 Aleyrodes proletella
L.(简称 A p )和伴生种群Aleyrodessp.(简称As)是入侵农田和温室作物、蔬菜的害虫。 2 0 1 2 ~ 2013年在我国北京(朝阳区)、新疆(乌鲁木齐市和吐鲁番市)均发现该种粉虱,该粉虱的传播速度较快,目前已入侵我国多个省(区)[7]。" A p 粉虱种群入侵我国新疆3年后,发现了与 A p 粉虱种群混合发生危害的一种粉虱种群Aleyrodessp.(简称As),两者虽然外部形态相近,但是具有可观察到的差异,通过分子生物学信息揭示,2个种群的基因特征差异对分析2个种群间的关系有重要意义。【前人研究进展 IA p 粉虱种群的主要寄主植物有甘蓝(cabbage)球芽甘蓝(brussels sprouts)、花菜(cauliflower)、西兰花(broccoli)、羽衣甘蓝(kale)等十字花科栽培蔬菜以及野生十字花科植物、多种菊科植物和其他植物等,共计12 科38 种(属)植物[1.4.8-9]。其对不同种类植物的嗜食程度不同,甚至同种寄主不同品种(系)的选择性、适应性和发生动态数量不同[9-10]。随着欧洲甘蓝粉虱入侵区域的逐渐扩大,其寄主植物种类还在不断增加[1,]。欧洲甘蓝粉虱在田间往往与烟粉虱Bemisiatabaci(Gennadius)和温室白粉虱Tri-aleurodesvaporariorum(Westwood)共处同一生境加重为害[12]。近年来,欧洲甘蓝粉虱已成为欧洲几种芸苔属作物的主要害虫[。甘蓝和油菜种植的增加,可以为欧洲甘蓝粉虱提供一个合适的寄主植物来繁殖和越冬[5];气候的变化与温带冬季,导致越冬死亡率下降;炎热的夏季促进了昆虫种群的增长,增加了每年的世代数[13-15];对杀虫剂的抗性[16]。害虫不仅通过若虫和成虫吮吸汁液,与植物争夺营养物质造成直接为害,导致寄主叶片黄化、提前落叶、落花甚至落果,成虫和若虫分泌的蜜露还诱发煤污病,影响植物的光合作用、作物的品质和观赏植物的观赏价值[8.17]。蜜露和煤污病降低了植物的光合作用和产品质量[18];而有关其是否是芸苔属植物的传播病毒载体尚不得而知[19]。As 种群与欧洲甘蓝粉虱 A p 成虫形态接近,但是有可观察到的差异,若虫则具有极显著的不同。2种类型的粉虱从卵、若虫、伪蛹到成虫之间均有不同之处。 A p 种群体淡黄色,菌丝体颜色为黄色,蜕皮在每个阶段正常脱落,第I腹节微刚毛长度约 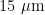 。成虫的腹部有棕色的蜡板,前翅有3个暗色标记。As种群体呈浅棕黄色,菌丝体颜色为橙红色,每个阶段的蜕皮叠加在一起,形成了屋顶瓦状的覆盖物,第I腹节微刚毛长度是$ A p \rrangle$ 的十几倍,约 2 0 0 μ m 。头部、胸部、腿部和腹部的棕色条纹比 A p 深。覆盖在翅膀上的蜡粉比$ A p \rrangle$ 的要多;前翅有2个暗色标记或组合成暗色条纹图案。由于所有杂交均不能产生雌性后代,在个体和群体水平上的杂交表明2种类型之间存在生殖隔离。As种群目前未检索到相关文献,多重序列比对结果2种粉虱的mtDNACOI基因相似性为 9 1 . 4 2 % ,而rDNAITS1基因相似性为
。成虫的腹部有棕色的蜡板,前翅有3个暗色标记。As种群体呈浅棕黄色,菌丝体颜色为橙红色,每个阶段的蜕皮叠加在一起,形成了屋顶瓦状的覆盖物,第I腹节微刚毛长度是$ A p \rrangle$ 的十几倍,约 2 0 0 μ m 。头部、胸部、腿部和腹部的棕色条纹比 A p 深。覆盖在翅膀上的蜡粉比$ A p \rrangle$ 的要多;前翅有2个暗色标记或组合成暗色条纹图案。由于所有杂交均不能产生雌性后代,在个体和群体水平上的杂交表明2种类型之间存在生殖隔离。As种群目前未检索到相关文献,多重序列比对结果2种粉虱的mtDNACOI基因相似性为 9 1 . 4 2 % ,而rDNAITS1基因相似性为
8 9 . 6 % 。对欧洲甘蓝粉虱和Aleyrodessp.进行正交和反交的杂交试验,均未能产生雌性后代,2种粉虱之间有生殖隔离,并达到了种的差异程度[20]。【本研究切入点】一般是一张叶片上首先发生少量同一种粉虱,随着时间推移,另一种粉虱陆续混入。多数情况下, A s 种群定植后 A p 种群混入,但2个粉虱种群均能够形成稳定的单一种群,也未观察到2种粉虱相互转变的现象。需研究2个粉虱种群的单一种群和混合种群在不同寄主植物上种群动态的差异,2个种群对寄主植物的选择性及混合发生对2个种群增长的影响。【拟解决的关键问题】分析比较田间自然条件下A p 和As在不同寄主植物上种群消长动态,研究2个种群消长规律的差异性,为进一步揭示2个种群间的关系提供依据。
材料与方法
1.1材料
试验在新疆农业大学农学院农药学实验室试验田(  )进行2年试验。试验田均分4块分别种植于油麦菜Lactucasativavarlongifoliaf.Lam(四季油麦,菜产地:甘肃省武威市祥林种苗有限责任公司)、甘蓝Brassicaoleraceavar.CapitataLinnaeus(绿圆40,产地:河北省邢台兴达种业有限公司)、青菜(油白菜)Brassicachinensisvar.Chinensis(四季黑油白菜,产地:沧州津力丰种苗有限责任公司)和菊科杂草毒莴苣(Lactucaser-riolaL),各植物间以 4 0 c m 宽小埂分隔开,行距为
)进行2年试验。试验田均分4块分别种植于油麦菜Lactucasativavarlongifoliaf.Lam(四季油麦,菜产地:甘肃省武威市祥林种苗有限责任公司)、甘蓝Brassicaoleraceavar.CapitataLinnaeus(绿圆40,产地:河北省邢台兴达种业有限公司)、青菜(油白菜)Brassicachinensisvar.Chinensis(四季黑油白菜,产地:沧州津力丰种苗有限责任公司)和菊科杂草毒莴苣(Lactucaser-riolaL),各植物间以 4 0 c m 宽小埂分隔开,行距为 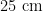 左右,均按当地通常时间播种,不使用化学杀虫剂防治供试植物上的任何害虫。
左右,均按当地通常时间播种,不使用化学杀虫剂防治供试植物上的任何害虫。
1.2 方法
1.2. 1 试验设计
从寄主植物上发现粉虱成虫时调查开始,直到粉虱消失或寄主植物生命周期结束为止。每3d调查1次。采用五点式取样法,每小区随机取5个样点,每样点随机选5株,取样时,毒莴苣等能分上、中、下部分叶片的寄主,在每株上、中、下3部分各随机取3张叶片,首先检查粉虱成虫数量,然后在40倍手持放大镜下观察统计每张叶片上粉虱卵、若虫和伪蛹的数量;对于叶片着生密集,难分上、中、下部分叶片的寄主(油麦菜、青菜、甘蓝等)调查整株叶片。每1次各样点选取1株具有代表性的寄主植物,采用叶面积仪(北京雅欣理仪科技有限公司,型号:Yaxin-1241)测量整株叶片的总面积,折算虫口密度(头/ 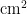 )。
)。
1.2.2 寄生性天敌寄生率调查
2 0 2 2 ~ 2 0 2 3 年,每年7\~9月,隔7d调查1次,从试验田各种植物上随机采集被寄生的2种粉虱种群各10张叶片,带回实验室,在显微镜下,用尖细的昆虫针或挑针去除卵、低龄若虫、干瘪虫体和空壳(指粉虱正常羽化的伪蛹壳和寄生蜂已羽化剩下的壳),只保留老龄若虫(3龄和伪蛹期)300头以上(1个叶片上同时存在2个种群,只保留1种粉虱)。叶片放置于铺有浸湿的2层滤纸的带盖培养皿(直径 1 4 . 5 c m ,高 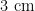 )中。用记号笔标记粉虱种类和日期置于智能人工气候箱,定期检查出蜂和正常羽化情况并计数。
)中。用记号笔标记粉虱种类和日期置于智能人工气候箱,定期检查出蜂和正常羽化情况并计数。
1.3 数据处理
试验数据处理采用MicrosoftExcel2019、SPSS20.0统计软件进行整理与作图。
2 结果与分析
2.12个粉虱单一种群在4种寄主植物上定居的时序特征
研究表明,自然条件下 A p 种群和 A s 种群均存在自然单一种群,同时在4种不同寄主植物上也混合发生,但发生的时间顺序上不同。毒莴苣和油麦菜是 A p 粉虱种群最主要的春夏寄主,油麦菜是主要的夏秋寄主;毒莴苣和油麦菜是 A s 粉虱种群春夏秋主要的寄主,甘蓝为2种粉虱种群主要的越冬寄主。
2.1.1 A p 种群在4种植物上发生的时序特征
研究表明,2022年 A p 种群在4种植物上发生的时间顺序有明显差异性,根据整个生活周期观察,毒莴苣是主要的春夏寄主,油麦菜是主要的夏秋寄主。2022年5月下旬在毒莴苣上始见低数量成虫,之后在寄主毒莴苣和油麦菜上虫口密度均逐渐上升。在毒莴苣上发生高峰期在7月上旬,于7月1日在毒莴苣上达到全年最高峰,虫口密度为0.540头 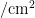 ,后因转移至寄主油麦菜上逐渐下降并趋于平缓;7月中旬起油麦菜上虫口密度显著上升,于8月6日达全年最高峰,虫口密度为0.701头/
,后因转移至寄主油麦菜上逐渐下降并趋于平缓;7月中旬起油麦菜上虫口密度显著上升,于8月6日达全年最高峰,虫口密度为0.701头/  O
O
2023年与2022年种群发生动态有较大差异性。2023年较2022年回温较晚且日均气温相差较大,导致 A p 粉虱种群少量雌成虫虽通过冬季在甘蓝上越冬,使得自调查之日起具有一定基数,但虫口密度直至7月上旬在各寄主植物上均保持较低水平。8月上旬和8月下旬在寄主油麦菜上 $ A p \rrangle$ 种群出现高峰期,其虫口密度均在0.23头 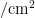 以上;在寄主毒莴苣上无明显高峰期,虫口密度为0 . 0 4 3 ~ 0 . 1 4 3" c m ;在寄主白菜和甘蓝上直至9月下旬虫口密度几乎为0;10月上旬起,在寄主甘蓝上虫口密度逐渐上升,最高达到0.046头/
以上;在寄主毒莴苣上无明显高峰期,虫口密度为0 . 0 4 3 ~ 0 . 1 4 3" c m ;在寄主白菜和甘蓝上直至9月下旬虫口密度几乎为0;10月上旬起,在寄主甘蓝上虫口密度逐渐上升,最高达到0.046头/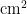 ,后趋于平稳。
,后趋于平稳。
A p 种群虫口密度春夏季受气候影响较大,主要发生于夏秋季,其寄主最主要为油麦菜,甘蓝为主要的越冬寄主。图1
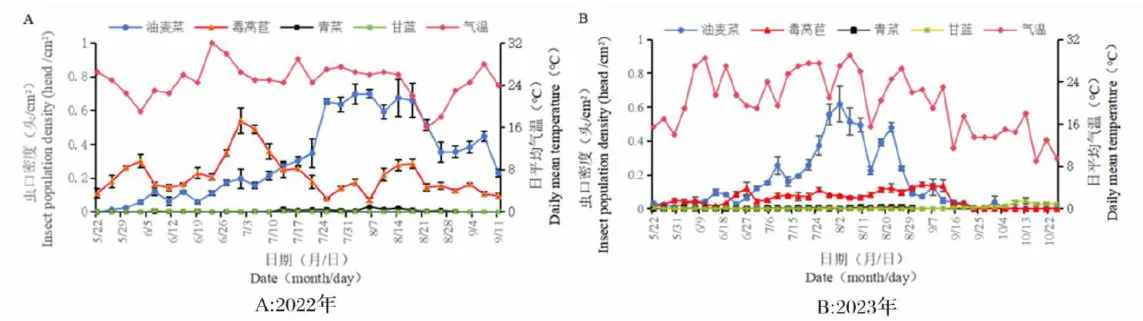 图1 A p 粉虱种群在4种寄主植物上定居的时序特征Fig.1 Temporal characteristics of colonization of the A p population on four host plants
图1 A p 粉虱种群在4种寄主植物上定居的时序特征Fig.1 Temporal characteristics of colonization of the A p population on four host plants2.1.2 A s 种群在4种植物上发生的时序特征
研究表明,2022年 A s 种群基本定居在寄主毒莴苣上并于7月中旬至8月下旬出现多次高峰期,虫口密度为 1 . 1 6 5 ~ 2 . 5 3 2 头  ;在寄主油麦菜上于7月下旬、8月中旬和8月下旬均出现1次高峰期,虫口密度为 0 . 5 3 4 ~ 1 . 2 6 7 头
;在寄主油麦菜上于7月下旬、8月中旬和8月下旬均出现1次高峰期,虫口密度为 0 . 5 3 4 ~ 1 . 2 6 7 头  ;在寄主青菜上虫口密度几乎为零。As种群发生较A p 种群晚,毒莴苣是As粉虱种群春夏秋最主要的寄主。
;在寄主青菜上虫口密度几乎为零。As种群发生较A p 种群晚,毒莴苣是As粉虱种群春夏秋最主要的寄主。
2023年 A s 种群雌成虫通过冬季在甘蓝上越冬,使得春夏季相比2022年虫口密度显著上升。在毒莴苣上高峰期为8月中旬,于8月18日达到全年最高峰,为2.207头/  ,9月上旬随着毒莴苣生命周期的结束,部分转移至油麦菜和甘蓝上。在寄主油麦菜7月中旬至8月下旬出现多次高峰期,虫口密度为 0 . 7 8 0 ~ 1 . 0 7 4 头
,9月上旬随着毒莴苣生命周期的结束,部分转移至油麦菜和甘蓝上。在寄主油麦菜7月中旬至8月下旬出现多次高峰期,虫口密度为 0 . 7 8 0 ~ 1 . 0 7 4 头  ;在寄主青菜上虫口密度几乎为零,寄主甘蓝上自10月上旬起虫口密度显著上升,最高达到0.576头
;在寄主青菜上虫口密度几乎为零,寄主甘蓝上自10月上旬起虫口密度显著上升,最高达到0.576头 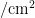 ,最终在甘蓝上越冬。
,最终在甘蓝上越冬。
As种群春夏秋季均主要发生于寄主毒莴苣和油麦菜上,甘蓝为其主要的越冬寄主。图2
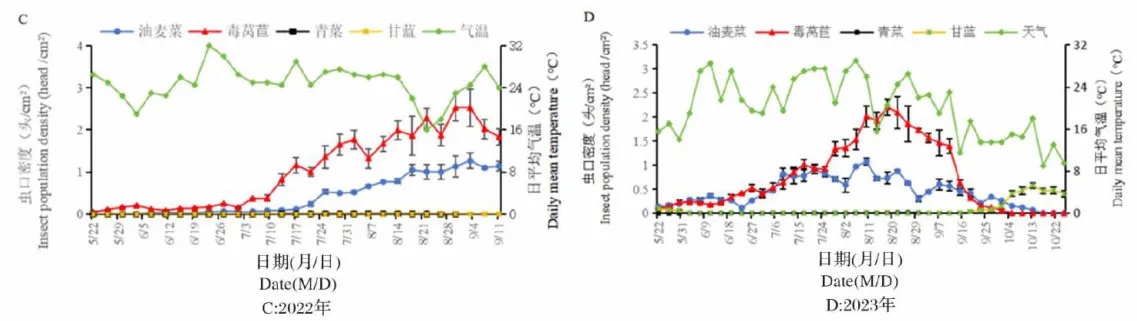 图2As粉虱种群在4种寄主植物上定居的时序特征Fig. 2 Temporal characteristics of colonization of the As population on four host plants
图2As粉虱种群在4种寄主植物上定居的时序特征Fig. 2 Temporal characteristics of colonization of the As population on four host plants2.22种粉虱混合种群在4种不同寄主上的消长动态
研究表明, A p 和As在4种不同寄主植物上均混合发生,但种群数量差异较大。4种植物比较,毒莴苣是2种粉虱均表现嗜好的寄主,种群密度最大,其次是油麦菜,然后是甘蓝,最后是青菜。
成虫始见于5月下旬,于10月下旬最终转移至寄主甘蓝上越冬,发生高峰期为7月中下旬至9月上旬,且主要发生在寄主毒莴苣和油麦菜上。2022年在毒莴苣自7月下旬进人盛发期,且具有多个峰期,全年最高峰为8月30日,为0.92头/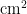 ,2023年自7月上旬出现小高峰后逐渐上升,无明显峰期,于8月18日达全年最高峰,为0.74头/
,2023年自7月上旬出现小高峰后逐渐上升,无明显峰期,于8月18日达全年最高峰,为0.74头/ 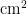 ;2022年在油麦菜上于7月下旬进入盛发期,9月7日达全年最高峰,为0.54头
;2022年在油麦菜上于7月下旬进入盛发期,9月7日达全年最高峰,为0.54头 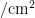 ;2023年自7月上旬进入盛发期,于8月22日达全年最高峰,为0.46头/
;2023年自7月上旬进入盛发期,于8月22日达全年最高峰,为0.46头/ 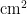 ,随着毒莴苣和油麦菜的生命周期结束,此时毒莴苣和油麦菜上的成虫迁移至甘蓝上,导致甘蓝上成虫的虫口密度逐渐上升,并于10月13日达到最高为0.622头
,随着毒莴苣和油麦菜的生命周期结束,此时毒莴苣和油麦菜上的成虫迁移至甘蓝上,导致甘蓝上成虫的虫口密度逐渐上升,并于10月13日达到最高为0.622头 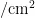 。由于成虫在甘蓝上越冬,2023 年高峰期较2022年提前,且成虫每一年的高峰期并不一致,但均集中在7\~9月,在寄主毒莴苣上的最高虫口密度高于寄主油麦菜。
。由于成虫在甘蓝上越冬,2023 年高峰期较2022年提前,且成虫每一年的高峰期并不一致,但均集中在7\~9月,在寄主毒莴苣上的最高虫口密度高于寄主油麦菜。
卵在寄主油麦菜、毒莴苣和白菜上均出现多峰现象,但在寄主甘蓝上至10月上旬虫口密度几乎为零,10月上旬起有小幅度升高,但依旧为较低水平,为 0 . 0 0 4 ~ 0 . 0 9 粒/ 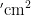 。2022年盛发期为7月中下旬至9月上旬,2023年盛发期于7月上旬开始,较2022年提前,与成虫的消长动态几乎一致。
。2022年盛发期为7月中下旬至9月上旬,2023年盛发期于7月上旬开始,较2022年提前,与成虫的消长动态几乎一致。
2种粉虱种群的若虫和蛹主要发生在寄主油麦菜和毒莴苣上,在寄主青菜和甘蓝上虫口密度几乎为零。在寄主毒莴苣上2022年8月上旬至9月上旬为 A p 和As混合种群若虫和蛹的盛发期,于9月3日达到全年最高峰,为1.792头 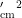 ;在油麦菜盛发期自7月下旬起,于8月30日达全年最高峰,为1.581头/
;在油麦菜盛发期自7月下旬起,于8月30日达全年最高峰,为1.581头/ 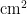 。2023年盛发期于7月中下旬开始,较2022年提前,总体较成虫及卵的盛发期滞后,但虫口密度显著高于成虫和卵。
。2023年盛发期于7月中下旬开始,较2022年提前,总体较成虫及卵的盛发期滞后,但虫口密度显著高于成虫和卵。
毒莴苣和油麦菜是粉虱混合种群的主要寄主,当成虫进入盛发期时,卵同样进人盛发期,若虫和蛹的盛发期较晚,但虫口密度较高。7月下旬至9上旬是混合种群在毒莴苣上的危害盛期,混合种群卵、若虫、伪蛹和成虫的总虫口密度两年平均达44.1头(粒) 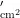 。8月下旬至9月上旬,随着寄主植物毒莴苣生命周期的结束,成虫逐渐迁移至其他寄主(主要为油麦菜)上为害。致使寄主植物油麦菜上成虫、卵、若虫和蛹在这段时间均能达到一次高峰,平均为0.52、0.75和1.22 头(粒)
。8月下旬至9月上旬,随着寄主植物毒莴苣生命周期的结束,成虫逐渐迁移至其他寄主(主要为油麦菜)上为害。致使寄主植物油麦菜上成虫、卵、若虫和蛹在这段时间均能达到一次高峰,平均为0.52、0.75和1.22 头(粒) 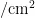 。随着寄主植物油麦菜生命周期的结束,叶片上的卵和成虫的数量逐渐下降并转移至寄主植物甘蓝上,且最终在寄主植物甘蓝上越冬。图3
。随着寄主植物油麦菜生命周期的结束,叶片上的卵和成虫的数量逐渐下降并转移至寄主植物甘蓝上,且最终在寄主植物甘蓝上越冬。图3
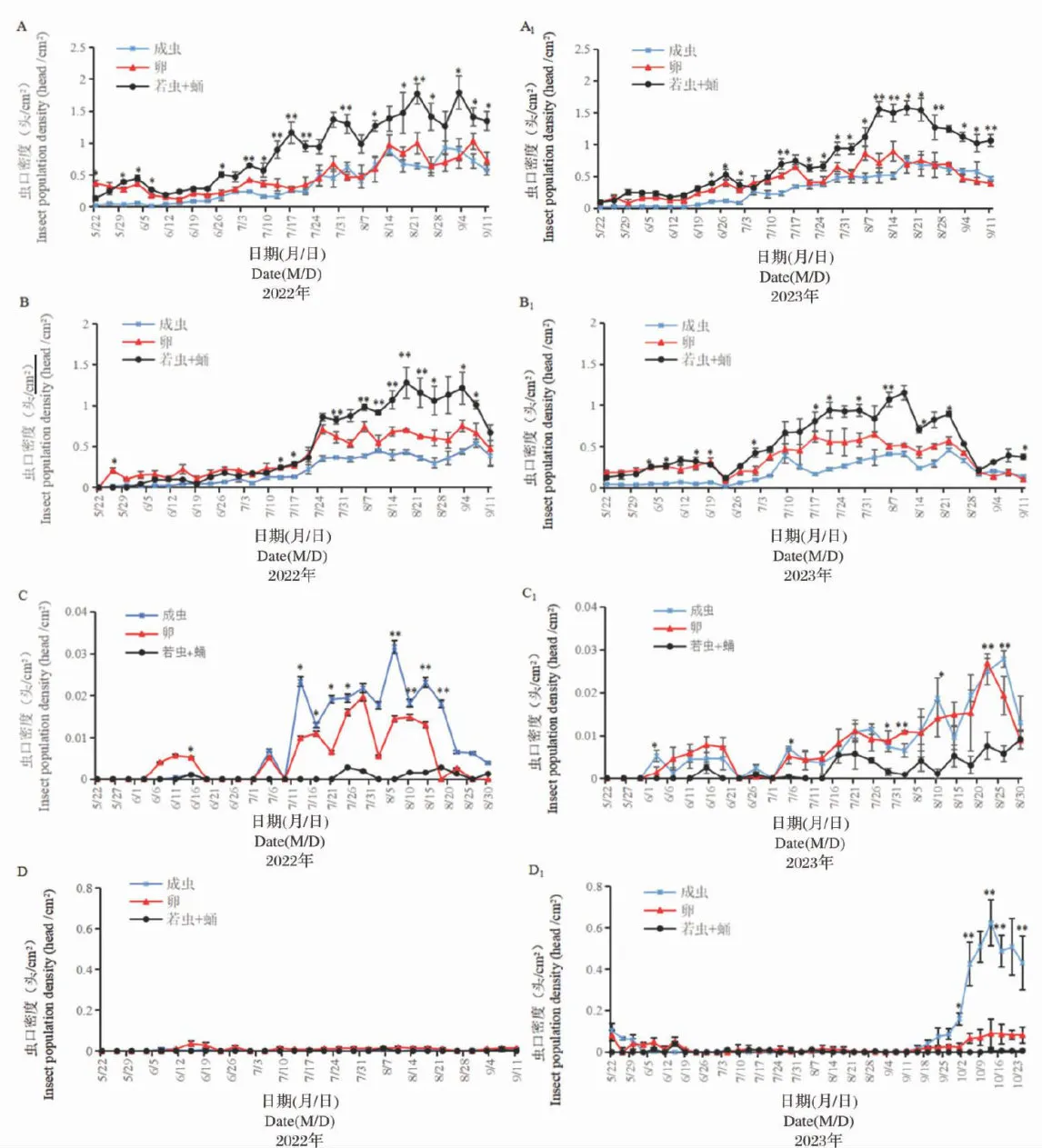 图32种粉虱混合种群在四种寄主植物上的消长动态
图32种粉虱混合种群在四种寄主植物上的消长动态3讨论
3.1欧洲甘蓝粉虱 Aleyrodes proletella L. ( A p ) 被认为是田间芸苔属作物的一种小型农业害虫[18,21-22]。试验研究将2个粉虱种群的寄主选择差异性和种群动态差异性进行对比分析, A p 种群为害多种十字花科蔬菜和野生杂草,但在不同寄主上的偏好性和种群动态不同。调节粉虱种群动态的主要因素之一是寄主植物的质量和适宜性[23]。烟粉虱与白粉虱的亲缘关系及其寄主植物已被反复研究[24-27],其发育时间、繁殖力和寿命因寄主植物种类而异。KhaldonAskoul等[28]通过研究发现, A p 种群在油菜上具有较高的繁殖力和成活率,且后代雌虫偏多,是 A p 种群非常适合的寄主植物。在欧洲,大多数油菜在冬季种植,而其它芸苔属品种主要在春季到秋季种植,这样的条件可以为 A p 种群提供全年合适的寄主植物。吉宇星等[29]通过室内研究得出 A p 种群和As种群的嗜好寄主为油麦菜和小白菜,但对油麦菜的嗜好程度高于小白菜,并且裸型甘蓝粉虱对油麦菜和小白菜的嗜好性偏高于甘蓝粉虱,非嗜好寄主均为甘蓝。与研究通过田间观察结果相一致,油麦菜为 A p 与As种群的主要寄主,毒莴苣为As种群在田间的最主要寄主。
3.2Nebreda等[9也报道了寄主植物种类会影响 A p 种群雌虫的平均日繁殖力和雌虫及雄虫的存活率。研究表明,雌雄虫成活率在白菜上最低,而在冬季油菜和球茎甘蓝上最高,该结果与Broekgaarden等[30]的发现相一致。可能是由于甘蓝植物的结构为欧洲甘蓝粉虱提供了更多的保护[6]。对球芽甘蓝(brussels sprouts)、皱叶甘蓝(savoycabbage)、羽衣甘蓝(kale)和甘蓝(cab-bage)(卷心菜)等4种十字花科蔬菜对欧洲甘蓝粉虱的敏感性进行了研究发现, A p 粉虱盛发期时,除甘蓝外,其余寄主植物上粉虱数量均显著增加,甘蓝为非嗜好寄主。除了在十字花科其他植物上繁殖外,其在花椰菜(cauliflower)和西兰花(broccoli)在田间的侵染率也很高[28,31]。 $ A p \rrangle$ 粉虱种群也被记录在蒲公英(dandelion)和苦苣菜(sow-thistle)上繁殖[31],记录均提到这些植物是作为关于 A p 粉虱的寄主植物[12,21]。在夏季和越冬世代之间,寄主的偏好存在差异,而冬季寄主的明显“偏好”很可能是基于结构特征,这些特征提供了更多的保护[32]。在 Mound and Halsey[33]研究中可以找到一份已知寄主植物的清单明细。采取种植抗虫的作物品种和减少欧洲甘蓝粉虱嗜食芸苔属蔬菜的种植面积等措施可减轻受害程度[9,33-34]
从寄主植物上定居的时序特征上可以看出,$ A p \rrangle$ 与As种群的始发期相差不大,均发生于5月下旬,但As种群暴发期较 $ A p \rrangle$ 种群推迟且暴发时长较长,且虫口密度显著高于 A p 种群。 $ A p \rrangle$ 种群主要于7月上旬至8月中下旬发生在寄主油麦菜上;而As种群主要于7月中旬至9月中上旬发生于寄主油麦菜和毒莴苣上。调查过程中还发现A p 种群一般出现在寄主植物中上部,而As种群一般出现在寄主植物中下部,其原因还有待进一步探究。
A p 和 A s 2 个种群的田间消长规律具有独立性,混合发生时种群表现为As种群影响 A p 种群,一般 A p 粉虱种群先定殖在寄主植物上,后As种群混入,且由于As种群从二龄若虫开始的蜕皮都如覆瓦状叠加覆盖在身上,且羽化前都不会脱落,受寄生性天敌影响较低,其在田间的存活率明显高于 A p 粉虱种群,但导致As粉虱种群影响 A p 粉虱种群的原因以及如何影响的行为还有待进一步观察和研究。
4结论
4.1 A p 粉虱种群主要发生在夏秋季,且主要寄主为油麦菜;As粉虱种群春夏秋主要寄主为毒莴苣和油麦菜;2个粉虱种群的始发期无明显差别,但 A p 种群盛发期较As种群提前;甘蓝为2种粉虱种群主要的越冬寄主。
4.2毒莴苣和油麦菜是粉虱混合种群的主要寄主,二者均具有较高的吸引 A p 和As产卵的潜在能力,并且十分有利于若虫取食、存活和发育,可使 A p 和As种群密度达到较高的水平。当成虫进入盛发期时,卵同样进入盛发期,若虫和蛹的盛发期较晚,但密度较高。7月下旬至9上旬是混合种群在毒莴苣和油麦菜上的为害盛期,10月中旬随着寄主植物油麦菜生命周期的结束,寄主上的大部分As成虫迁移到甘蓝上越冬。油麦菜更吸引 A p 种群而毒莴苣更吸引 A s 种群。混合发生时种群表现为 A s 种群影响 A p 种群,一般 $ A p \rrangle$ 粉虱种群先定殖在寄主植物上,后As种群混入,且盛发期时混合种群中 A s 粉虱数量较多,故As粉虱种群较 A p 粉虱种群为害更大。
参考文献(References)
[1]MoundLA,HalseySH.Whiteflyoftheworld:asystematiccatalogueoftheAleyrodidae(Homoptera)withhostplantandnatural enemydata[M].London:BritishMuseum(Natural History), 1978.
[2]Hill D S.Agricultural insect pests of temperate regions and their control[M].Cambridge:CambridgeUniversityPress,1987.
[3]MunizM,Nebreda M .Differential variationin hostpreference of Aleyrodesproletella(L)onsomecauliflowercultivars[J].AleyrodesProletellaHostPreference,2003.
[4]Ramsey A D,EllisP R. Resistance in wild brassicas to the cabbagewhitefly,Aleyrodesproletella[J].ActaHorticulturae,1996, (407):507-514.
[5]RichterE,HirtheG.HibernationandmigrationofAleyrodesproletella inGermany[J].BulletinOepp/eppoBulletin,2014,107: 143-149.
[6]SpencerC.Thebiologyand ecologyof Aleyrodesproletella,the cabbagewhitefly:apest ofBrassicacrops[D].Coventry,West Midlands,UK:UniversityofWarwick,2016
[7]张桂芬,冼晓青,张金良,等.甘蓝粉虱入侵中国大陆[J]. 生物安全学报,2014,23(1):66-70. ZHANG Guifen,XIAN Xiaoqing,ZHANG Jinliang,etal.Cabbagewhitefly,Aleyrodesproletella(L.)(Hemiptera:Aleyrodidae),invaded Chinasmainland[J].Journal ofBiosafety, 2014,23(1):66-70.
[8」Trdan S,Kac M,Bobnar A,et al. Research on the efficacy of the yellow sticky boards to control the cabbage whitefly(Aleyrodes proletellaL.Aleyrodidae)on Brussels sprouts[J].Kmetijstvo, 2003,81(1) :171-177.
[9]Nebreda M,Nombela G,Muniz M.Comparative host suitability ofsomeBrassica cultivars for the whitefly,Aleyrodesproletella (Homoptera:Aleyrodidae)[J].Environmental Entomology, 2005, 3 4 ( 1 ) : 2 0 5 - 2 0 9
[10]Trdan S,Papler U.Susceptibilityof four diferent vegetable brassicas to cabbage whitefly(Aleyrodes Proletella L.,Aleyrodidae)attack[J].Mededelingen(Rijksuniversiteit Te Gent Fakulteit VandeLandbouwkundigeEn ToegepasteBiologische Wetenschappen),2002,67(3):531-535.
[11]Chen C H, Kumar Dubey A,Ko C C. Comparative morphological studies on two species of Aleyrodes (Hemiptera:Aleyrodidae) [J].The Pan-Pacific Entomologist,2007,83(3): 244-254.
[12]De BarroPJ,Carver M.Cabbage whitefly,Aleyrodes proletella (L.)(Hemiptera:Aleyrodidae),newly discovered in Australia [J]. Australian Journal of Entomology,1997,36(3): 255- 256.
[13]BaleJS,MastersGJ,Hodkinson ID,etal.Herbivoryin global climate change research: direct effects of rising temperature on insect herbivores[J].Global Change Biology,2002,8(1):1 -16.
[14] Curmutte L B, Simmons A M,Abd - Rabou S. Climate change and Bemisia tabaci(Hemiptera:Aleyrodidae):impacts of temperature and carbon dioxideon life history[J].Annals of the Entomological Society ofAmerica,2014,107(5): 933-943.
[15]PorterJH,ParryML,Carter TR.The potential effects of climatic change on agricultural insect pests[J]. Agricultural and ForestMeteorology,1991, 5 7 ( 1 / 2 / 3 ) : 2 2 1 - 2 4 0 :
[16]Springate S,Colvin J.Pyrethroid insecticide resistance in British populationsof thecabbagewhitefly,Aleyrodesproletella [J].Pest Management Science,2012,68(2):260-267.
[17]Labanowski,G.S.Cabbagewhitefly—Aleyrodes proletella(L. 1758)—pest of Brassica vegetables in Poland[J]. Zesz.Nauk. Inst.Ogrod,2015 23:49-61.
[18]Martin JH,Mifsud D,Rapisarda C.The whiteflies (Hemiptera:Aleyrodidae)of Europe and the Mediterranean Basin[J]. Bulletin of Entomological Research,2000,90(5) : 407-448.
[19]Tomlinson JA,Webb M JW,Faithfull E M. Studies on broccoli necrotic yellows virus[J]. Annals of Applied Biology,1972, (204号 7 1 ( 2 ) : 1 2 7 - 1 3 4 二
[20]Kuwan A,ZhangGF,LiJH,et al.Morphological,genetic andbiological differences in two populations of Aleyrodes proletella from Northwestern China[J].Entomologia Generalis,2021,41 (1):27 -37.
[21]Dale P S,Hayes JC,Johannesson J.New records of plant pests in New Zealand[J]. New Zealand Journal of Agricultural Research,1976,19(2):265-269.
[22]IheagwamEU.Photoperiodism inthecabbage whitefly,Aleyrouts viussuuc[J」. I njsuvguul Liuvuwwg , 1 184.
[23]LenterenJC,NoldusL.Whitefly-plant relationships:behavioural and ecological aspects[J].In Gerling,D.(ed.),Whiteflies:their Bionomics,Pest Status and Management.Intercept Ltd.,Andover,UK.,1990
[24]CoudrietDL,PrabhakerN,Kishaba AN,etal.Variation in developmental rate on diferent hostsand overwintering of the sweetpotato whitefly,Bemisia tabaci(Homoptera:Aleyrodidae) [J].Environmental Entomology,1985, 1 4 ( 4 ) : 5 1 6 - 5 1 9 :
[25] Campos OR,Crocomo WB,Labinas A M.Comparative biologyof thewhitefly Trialeurodes vaporariorum(West.)(Hemiptera -Homoptera:Aleyrodidae)on soybean and bean cultivars[J]. Neotropical Entomology,2003,32(1):133-138.
[26]Manzano MR,van Lenteren JC.Life history parameters of T r i 三1 aleurodes vaporariorum(Westwood)(Hemiptera:Aleyrodidae) at diffrent environmental conditions on two bean cultivars[J]. Neotropical Entomology,2009,38(4): 452-458.
[27]Lorenzo ME,Grille G,Basso C,et al.Host preferences and biotic potential of Trialeurodesvaporariorum and Bemisia tabaci (Hemiptera:Aleyrodidae)in tomato and pepper[J].Arthropod -Plant Interactions,2016,10(4):293-301.
[28]Askoul K,Richter E,Vidal S,et al. Life history parameters of Aleyrodes proletella(Hemiptera:Aleyrodidae)on different host plants[J].Journal of Economic Entomology,2019,112(1): 457-464.
[29]吉宇星,帕提玛·乌木尔汗,张瑞星月,等.两个欧洲甘蓝 粉虱种群的线粒体基因组与寄主选择性[J].新疆农业大学 学报,2022,45(6):474-479. JI Yuxing,Patima Wumuerhan,ZHANGRuixingyue,et al. Mitochondrial genome and host selectivity of two populations of Europeancabbage whitefly[J].Journal of Xinjiang Agricultural University,2022,45(6):474-479.
[30]Broekgaarden C,Riviere P,Steenhuis G,et al.Phloem-specificresistance in Brassica oleracea against the whitefly Aleyrodes proletella[J].Entomologia Experimentalis et Applicata,2012, 142(2):153-164.
[31]Butler C.Onthe ecology ofAleurodesbrassicaeWalk.(Hemiptera)[D].Cambridge:Cambridge University,1938.
[32]Mound L A,Halsey SH.Whitefly of the world: a systematic catalogue of the Aleyrodidae ( Homoptera) with host plant and natural enemydata[M].London:British Museum(Natural History),1978.
[33]Ramsey A D,Elis PR.Resistance in wild brassicas to the cabbagewhitefly,Aleyrodesproletella[J].Acta Horticulturae,1996, (407): 507-514.
[34]Broekgaarden C,Pelgrom K TB,Bucher J,et al. Combining QTL mapping with transcriptome and metabolome profiling reveals a possble role for ABA signaling in resistance against the cabbage whitefly in cabbage[J].PLoS One,2018,13(11): e0206103.
Dynamics analysis and comparison of Aleyrodes proletella L. and its associated population Aleyrodes sp. on different host plant
ZHANG Ruixingyue, SUN Yingying, JI Yuxing,MA Deying
( Key Laboratory of Monitoring and Safety Prevention and Control of Agriculture and Forest Pests/ College of Agriculture, Xinjiang Agricultural University/Key Laboratory of Prevention and Control of Invasive Alien Species in Agricultureamp; Forestry of the North -western Desert Oasis (Co-constructed by Ministry and Province), Ministry of Agriculture and Rural Affirs, Urumqi 830o52,China)
Abstract:【Objective】 That have invaded at present, the information on the population dynamics of A p is limited,and there are no research reports on the regularity of the population dynamics of A s population. Therefore,it is urgent for us to compare and clarify the dynamics and diferences of growth and decline between two different populations of Aleyrodes,in order to provide a basis for further revealing the relationship between the two populations.【Methods】In 2022-2023,we selected B . oleracea convar. capitata L.,Brassica chinensis var. chinensis and Lactuca sativa var. longifolia Lam,which mainly grew in this area,and the invasive Asteraceae weed L . serriola L as test plants under outdoor conditions for two consecutive years,the host selectivity of the Aleyrodes proletella L.and Aleyrodes sp.was explored and the population growth dynamics of the two whiteflies comparatively on different host plants were analyzed.【Results】 The results showed that L . ,serriola L. and Lactuca sativa var. longifolia Lam. were the most dominant spring and summer hosts of Aleyrodes proletella L.populations,and Lactuca sativa var. longifolia Lam.r was the primary summer and fall host; L .serriola L.was the main host of the Aleyrodes sp. population in spring,summer and autumn. Both hosts were highly favorable for feeding,survival,and development of the two population of Aleyrodes.,which could lead to high population densities of two population of Aleyrodes.B.oleracea convar.capitata L. was the primary overwintering host for two whitefly populations.Field investigation showed that from late July to early September, the maximum damage period of mixed population on L . serriola L. was observed,and the total density of eggs, nymphs,pseudopupa and adults was 4O.7 head(grain)  .In early August,the density of nymphs and pseudopupa of mixed population reached the highest in Lactuca sativa var. longifolia Lam.,which was 0 . 7 (2 head
.In early August,the density of nymphs and pseudopupa of mixed population reached the highest in Lactuca sativa var. longifolia Lam.,which was 0 . 7 (2 head  . On the host L . serriola L.,the population density of Aleyrodes proletella L. reached the highest level in late June,which was O.54 head/cm².After that,the population density began to decrease gradually and tended to zero due to the parasism and migration of natural enemies to other host plants such as Lactuca sativa var. longifolia Lam. The outbreak of nymphs in Aleyrodes sp. population was relatively delayed on Lactuca sativa var. longifolia Lam.【Conclusion】The comparative analysis of this study reveals that there were significant diffrences in the growth and decline dynamics of the two populations,Aleyrodes proletella L.and Aleyrodes sp.,which provides a basis for further revelation of the relationship between the two populations.
. On the host L . serriola L.,the population density of Aleyrodes proletella L. reached the highest level in late June,which was O.54 head/cm².After that,the population density began to decrease gradually and tended to zero due to the parasism and migration of natural enemies to other host plants such as Lactuca sativa var. longifolia Lam. The outbreak of nymphs in Aleyrodes sp. population was relatively delayed on Lactuca sativa var. longifolia Lam.【Conclusion】The comparative analysis of this study reveals that there were significant diffrences in the growth and decline dynamics of the two populations,Aleyrodes proletella L.and Aleyrodes sp.,which provides a basis for further revelation of the relationship between the two populations.
Key Words:Aleyrodes proletella L. ; Aleyrodes sp. ; population dynamics ; host plant selectivity

