
摘" 要:石榴花为两性花原基,石榴胚珠为双珠被、厚珠心的倒生型胚珠,胚珠正常发育的花为完全花,胚珠发育异常形成不完全花,花后脱落,是造成落花落果、坐果率低和树体养分流失的主要原因,严重影响石榴产量和果实品质。从石榴胚珠发育形态解剖学、内源激素以及INO、CRC、BEL1、STK等转录调控因子在石榴胚珠发育中的功能等方面,综述近年来石榴胚珠发育研究进展。
关键词:石榴;完全花;不完全花;胚珠;发育机制
中图分类号:" S665.4" 文献标识码:" A
文章编号:" 1002-2910(2024)05-0006-06
Research progress on the development of pomegranate ovules
ZHAO Yujie1, JIAO Jian 1, ZHENG Xianbo1, YUAN Zhaohe2*
(1.Henan Agricultural University, Zhengzhou, Henan 450046, China;2.Nanjing Forestry University, Nanjing, Jiangsu 210037,China)
Abstract:Pomegranate flower is bisexual flower primordium, abnormal ovule development forms functional maleflowers, and normal ovule development flowers are bisexualflowers. Pomegranate ovules are inverted ovules with double integuments and thick nucellate. The formation of functional maleflower is due to abnormal and stagnant development of ovule integument. Functional male flower typically drop and fail to set fruit. Thess result in flower and fruit dropping, low fruiting rate and loss of tree nutrients, which affects the yield and fruit quality of pomegranate.This review focuses on the study of pomegranate ovule development in recent years, including the morphoanatomy study ofovule development, endogenous hormones, the functions of INO, CRC, STK, and BEL1 transcriptional regulatory factors in pomegranate ovule development.
Key words:pomegranate; bisexual flower; functional male flower; ovule;developmental mechanism
收稿日期:2024-05-27
基金项目:河南省科技攻关项目(242102110284)。
*通信作者:苑兆和(1963-),男,山东招远人,教授,从事石榴种质资源与遗传育种及生物信息学研究。E-mail: zhyuan88@hotmail.com
作者简介:赵玉洁(1988-),女,河南开封人,副教授,从事果树分子生物学与遗传育种、石榴和苹果发育生物学等相关研究。
E-mail: z1184985369@163.com
石榴(Punica granatumL.)是一种具有食用价值、药用价值及保健功能的水果,深受大众喜爱,具有巨大的市场潜力。石榴花分为完全花和不完全花两种类型,完全花的子房肥大、室多,花柱长而直,为可育雌蕊;不完全花的胚珠发育异常,子房瘦小,室少,花柱细短,柱头小,为不育雌蕊。石榴花为两性花原基,不完全花雌蕊败育是由于胚珠发育异常(胚珠内珠被原基形成后发育停滞,导致胚珠发生不同程度的退化),不能形成卵细胞所致[1,2]。石榴胚珠为双珠被、厚珠心的倒生型胚珠,子房中胚珠的数量直接决定石榴籽粒数量,石榴籽粒由革制坚硬的内种皮和肥厚多汁的外种皮构成[3],进而影响果实大小。石榴心皮愈合形成子房室后,在子房内壁发育出半球状胎座,然后胎座上形成许多胚珠原基。不完全花由于胚珠发育异常,花后脱落,是造成落花落果、坐果率低和树体养分流失的主要原因,严重影响生产中石榴的产量和果实品质。因此,研究石榴胚珠发育及其调控机制尤为重要。
1石榴胚珠发育形态解剖学研究
石榴花具有独特的合心皮雌蕊,由一个细长花柱、盘状柱头和子房形成。花柱四周围绕着花药,花药在底部扩大成一个锥形柱基。石榴的子房下位,结构特殊,发育模式高度复杂。石榴完全花和不完全花花形和大小显着不同,完全花外形筒状,子房发育饱满;不完全花花形钟状,子房败育,花柱长度低于雄蕊高度[4,5]。突尼斯、大籽、泰山红和Angel Red四个品种的完全花和不完全花发育形态差异明显,不完全花的子房均为瘦小状,且花大小明显小于完全花。完全花花柱长度高于不完全花,且不完全花花柱长度在四个品种中无差异;完全花子房纵径和横径均大于不完全花,且差异显着[4]。以上研究表明,不同品种石榴不完全花雌蕊败育的特征明显,且石榴雌蕊败育现象具有普遍性。
石榴胚珠为双珠被(外珠被和内珠被)。观察泰山红石榴胚珠发育的组织结构发现,石榴完全花和不完全花花蕾纵径3.0~5.0 mm时,胚珠原基开始形成,胚珠形态均未出现差异。花蕾纵径5.1~8.0 mm时,完全花胚珠伸长并开始弯曲生长,不完全花胚珠伸长生长。花蕾纵径在8.1~10.0 mm时,完全花胚珠内珠被和外珠被原基形成,并弯曲呈90°生长;不完全花胚珠弯曲生长,未观察到珠被原基形成。花蕾纵径为10.1~13.0 mm时,完全花外珠被比内珠被较快生长,呈现半封闭状态,大孢子孢原细胞和大孢子母细胞被形成;不完全花胚珠呈90°弯曲,极少胚珠分化出珠被原基。花蕾纵径为13.1~15.0 mm时,完全花发育成成熟胚珠;不完全花胚珠发育停滞在珠被原基形成期[6]。以上结果证实,花蕾纵径为8.0~13.0 mm时期是石榴胚珠发育的关键时期。
2石榴完全花和不完全花发育生理生化研究
2.1石榴花发育过程中内源激素含量变化分析
植物激素是调控植物生长与发育的一类重要物质[7,8]。分析泰山红石榴花发育过程中内源激素含量变化表明,在完全花花原基中脱落酸(ABA)、赤霉素(GA)含量高可能诱导子房败育,促进雄蕊器官发育,从而发育成为不完全花[9]。在花蕾纵径为3.0~14.0 mm阶段,不完全花中吲哚乙酸(IAA)的含量高于完全花,而在花发育后期完全花含量高于不完全花。玉米素核苷(ZR)和油菜素内酯(BR)含量变化呈现相似的变化趋势,在花蕾纵径为10.1~20.0 mm阶段,完全花中的含量高于不完全花。在花蕾纵径为3.0~12.0 mm 阶段,茉莉酸(JA)含量在完全花和不完全花中无差异;花器官成熟发育期,完全花含量高于不完全花。GA、ZR和ABA可能促进雌性花器官败育,这与赤霉素可促进部分植物的雄性表达并参与其雄性表达相一致[10],但与ABA对瓜类植物的雌化作用和细胞分裂素起促雌作用的报道相悖,说明同种激素对不同植物的效应并不一致,这可能是由于不同植物的调控性别表达的机理不同[8,11,12]。高含量激动素(KT)和IAA与低含量的ABA利于甜光颜石榴完全花的生长,尤其是植物激素生长促进物质和低含量的生长抑制物质之间的平衡,对完全花的发育和后期坐果起关键作用[13]。
2.2石榴花发育过程中酶活性变化分析
大量研究表明,酶活力与植物器官分化有一定的相关性。在石榴不完全花中超氧化物歧化酶SOD活性显着高于完全花,过氧化氢酶CAT活性在完全花和不完全花中差异不显着。苦瓜性别分化过程中,过氧化物酶POD和SOD活性与雌性呈正相关,而CAT活性与雄性呈正相关[14]。青钱柳雌花中POD活性较高,而CAT活性在雌花中活性最低[15]。核桃雄花生理分化阶段SOD活性没有明显的变化,而POD活性呈现最高峰;雌花生理分化阶段SOD活性变化比较平稳,而POD活性出现最高峰[16]。综合以上研究表明,不同物种花器官分化过程中酶活性与雌雄器官分化关系也有所不同。
3" 石榴胚珠发育分子机制研究
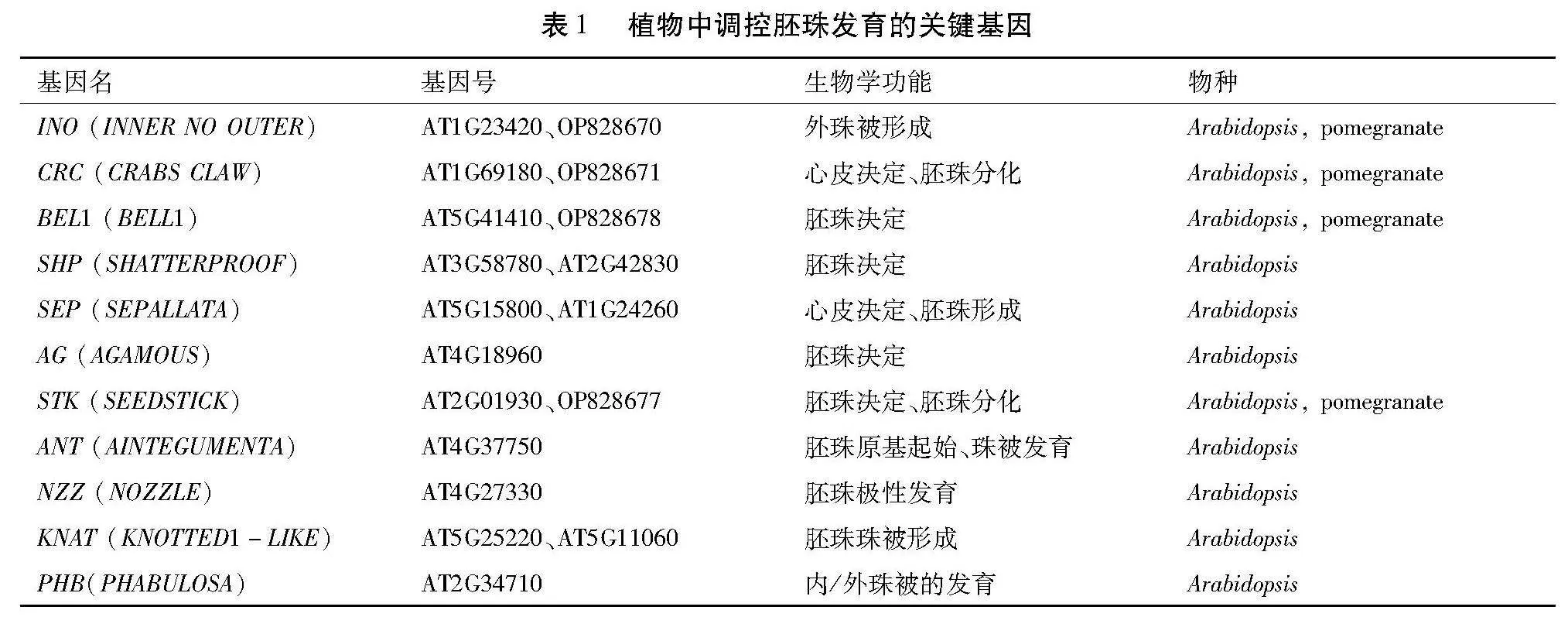
石榴花器官发育受多种因素的影响和调控,已知调控植物胚珠发育中MADS-box[17,18]、YABBY[19-21]和TALE[22]等转录调控因子占据非常重要的地位(表1)。
3.1" INO基因调控石榴胚珠发育机制
植物YABBY转录因子家族成员INO参与胚珠极性的决定[23]和外珠被发育[24],在单珠被和拟南芥的双珠被中INO仅在珠被最外层细胞中特异性表达,表明INO功能在不同物种内具有保守性[25-27]。研究报道,BRs通过BZR1介导INO的转录来调控外珠被的发育[28]。石榴中鉴定出一个INO同源基因,PgINO蛋白定位在细胞核具有典型的转录因子的亚细胞定位特性。在石榴花发育过程中,PgINO完全花表达量高于不完全花,且在完全花胚珠发育的关键阶段表达量呈上升趋势。转基因功能验证发现,在拟南芥花序和幼果发育期过表达石榴PgINO基因促进STK基因的表达。35S::PgINO转基因拟南芥株系花序形态和花苞数量与野生型较为一致,INO回补株系花苞数量较野生型数量明显少;35S::PgINO和35S::PgINO/ino株系果荚和野生型拟南芥果荚形态较为一致[6]。35S::PgINO转基因T3株系单果荚种子平均为34.8,数量均高于野生型,且差异显着;35S::PgINO/ino系种子数量高于野生型,但差异不显着。GUS组织染色结果表明,PgINO在花、种子发育中表达,但在叶片中不表达[4,6],表明PgINO参与石榴花序、种子和种皮的发育过程。以上结果表明,石榴PgINO参与调控胚珠和种子发育。
3.2" CRC基因调控石榴胚珠发育机制
在多数植物中,CRC基因以单拷贝形式存在,但在茄科植物中以CRCa/CRCb(Petunia hybrida)或CRC1/CRC2(Solanum lycopersicum)存在[29-31],这是由于茄科植物进化过程中的α六倍体复制的结果[32]。在矮牵牛中,2个PhCRC基因是蜜腺发育所必需的[30];但在番茄中,SlCRCa在幼嫩花芽中特异性表达,SlCRCb在幼嫩花芽和花中表达[29,31]。在crc knu双突变体的花分生组织发育表现出不稳定性[33],而crc突变体部分表型能被生长素运输抑制剂所恢复[34]。在多种被子植物crc突变体中,花序分生组织的发育同样具有不稳定性[33]。
石榴中鉴定出一个CRC同源基因PgCRC,其蛋白定位在细胞核。在石榴胚珠发育的关键阶段,PgCRC在完全花中的表达量高于不完全花[6]。转基因功能研究表明,在转录水平上,PgCRC促进STK和SEP3表达[4,6]。35S::PgCRC过表达拟南芥株系的花苞数量明显减少,35S::PgCRC/crc回交株系花苞数量也明显较野生型数量少;35S::PgCRC/crc株系和野生型拟南芥果荚发育正常,但35S::PgCRC/crc株系部分果荚顶端出现发育缺陷[6]。35S::PgCRC转基因T3株系单果荚种子平均为33.6,种子数量高于野生型(平均26粒),且差异显着;35S::PgCRC/crc回交株系的种子数量少于野生型,且差异显着。35S::PgCRC转基因株系和crc突变体回补株系的GUS染色结果表明,PgCRC在花序、种子和种皮中表达[4,6]。以上结果表明,石榴PgCRC基因参与调控胚珠发育。
3.3" BEL1基因调控石榴胚珠发育机制
BEL1在胚珠珠被和表皮细胞中表达,是调控胚珠发育的重要基因之一[41,42]。植物AG-SEP-BEL1模型调控心皮的发育,并调控WUS(WUSCHEL)表达;在胚珠中,BEL1负调控AG基因表达[43,44]。研究发现,WUS在bel1突变体的异常珠被组织处异位表达,表明BEL1在合点处抑制WUS的表达[44,45]。石榴BEL1同源基因功能研究表明,35S::PgBEL1拟南芥株系花序的花苞数量明显较野生型数量少,35S::PgBEL1株系果荚发育正常。35S::PgBEL1转基因株系的种子数量均少于野生型,且差异显着。在转录水平上,PgBEL1在花序发育中抑制INO和SEP3基因的表达,但可以促进CRC的表达;在幼嫩果荚中PgBEL1促进INO和SEP3基因的表达[4-6]。研究表明,PgBEL1参与调控石榴胚珠发育。
3.4" STK基因调控石榴胚珠发育机制
植物中已鉴定出的胚珠特征决定基因有拟南芥SEEDSTICK(STK,即AGL11)、SHATTERPROOF1/2(SHP1/SHP2,即AGL1/AGL5)[35,36]和矮牵牛FLORAL BINDING PROTEIN7/11(FBP7/11)[37]等。STK与FBP7/11属于同源基因,其在决定胚珠特征、珠柄的正常生长及种子发育过程中均发挥重要的作用[36]。在拟南芥中,STK参与调控胚珠和种子正常发育,其表达具有很强的时间特异性和组织特异性[38,39]。石榴STK同源基因PgAGL11CDS全序列696 bp。PgAGL11在雌蕊中表达量显着高于其他花器官,且在胚珠败育关键时期(花蕾纵径8.1 ~ 15.0 mm),完全花雌蕊中表达量极显着高于不完全花雌蕊;PgAGL11过量表达转基因拟南芥花表现为雄蕊变短,花瓣变小,花柱变长,柱头表面乳突状物质变长[40]。研究结果初步证明,PgAGL11可能在石榴雌蕊败育过程中发挥重要作用。
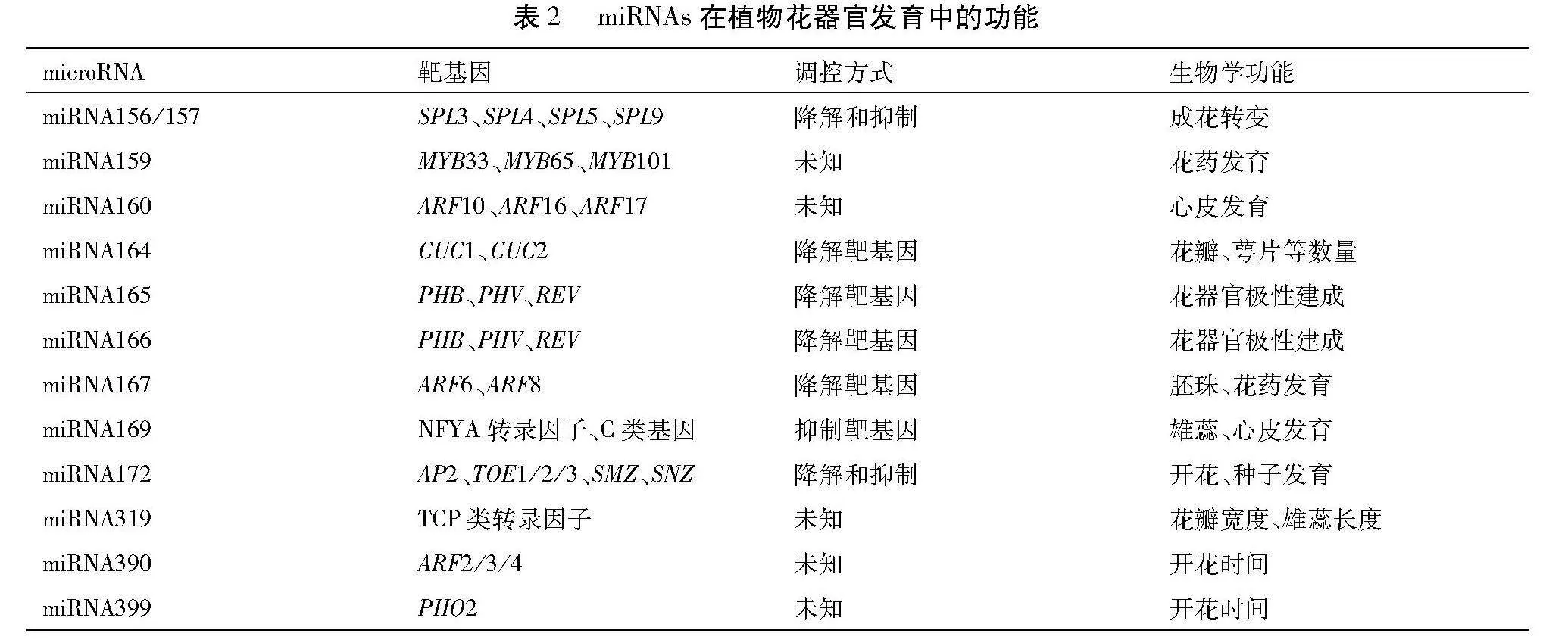
3.5石榴miR166调控胚珠发育机制
miRNA(microRNA)是一类真核生物自身基因的非编码小分子RNAs,长度多数为21~24 nt[46,47]。在细胞核中,RNA聚合酶Ⅱ转录miRNA基因生成具有茎环结构的pri-miRNAs,随后在Dicer酶剪切作用下生成miRNA/miRNA双链,最终miRNA链在细胞质中与AGO等蛋白结合形成RNA诱导沉默复合体,进而调控靶基因。植物miRNA自2002年在拟南芥中被首次报道以来[48],大量研究表明其在转录后水平上发挥着重要的调节作用,参与植物生长发育调控(表2)[47,49]。
miR165/166在分生组织活动调控方面与花器官中分生组织的形成密切相关[50]。miR165/166的过表达影响花器官发育,如在men1和jba-1D突变体中miR166被过表达,突变体的雌蕊群很小、心皮数量减少。研究表明,石榴Pg-miR166a-3p在不完全花雌蕊中表达量显着高于完全花。35S::Pg-miR166a-3p转基因拟南芥植株表现为种荚变小、种子数量减少、株高变低、花原基数量和植株分支数量增多,种子数量减少的主要原因为胚珠原基数量减少[51]。Pg-miR166a-3p可能通过调控靶基因表达影响胚珠发育而参与调控雌蕊败育[51]。
4" 小结与展望
石榴胚珠发育研究表明,花蕾纵径8.0~13.0 mm是石榴不完全花胚珠败育的关键阶段,PgINO、PgCRC、PgBEL1和PgSTK是调控石榴胚珠发育的重要因子。但是,PgINO、PgCRC和PgBEL1上游调控因子以及PgSEPs、PgAG在石榴胚珠发育中的功能及其与胚珠发育相关基因的协同调控关系尚不明确。对石榴胚珠发育研究不仅可拓展园艺植物胚珠发育理论体系,而且对石榴花期管理具有重要的意义。
参考文献:
[1]" 蔡永立,卢心固,朱立武.粉皮石榴花芽分化研究[J].园艺学报,1993,20(1): 23-26.
[2]" Chen L N, Zhang J, Li H X, et al. Transcriptomic analysis reveals candidate genes for female sterility in pomegranate flowers[J]. Front Plant Science, 2017(8): 1430.
[3]" 秦改花,刘春燕,徐义流,等. 石榴种皮结构及发育过程的显微观察[J]. 热带作物学报,2018,39(3):489-493.
[4]" 赵玉洁.石榴胚珠发育机理及关键转录因子功能研究[D].南京:南京林业大学,2023.
[5]" Wetzstein H Y, Ravid N, Wilkins E, et al. A morphological and histological characterization of bisexual and male flower types in pomegranate[J]. Journal of the American Society for Horticultural Science, 2011, 136(2): 83-92.
[6]" Zhao YJ, Wang YY, Yan M, et al. BELL1 interacts with CRABS CLAW and INNER NO OUTER to regulate ovule and seed development in pomegranate[J]. Plant Physiology, 2023, kiac554.
[7]" WangZ X, Jiao Z Q, Xu P L, et al. Bisexual flower ontogeny after chemical induction and berry characteristics evaluation in male Vitis amurensis Rupr[J]. Scientia Horticulturae, 2013(162): 11-19.
[8]" Golenberg E M, West N W. Hormonal interactions and gene regulation can link monoecy and environmental plasticity to the evolution of dioecy in plants[J]. American Journal of Botany, 2013, 100(6): 1022-1037.
[9]" Zhao Y J, Liu C Y, Yan M, et al. Variation of endogenous phytohormone in functional male and bisexual flowers of pomegranate (Punica granatumL.) during development[J]. Pakistan Journal of Botany,2021,53(2).
[10]" 邹竣竹,韩蕾,孙振元.环境因子和植物激素在植物性别表达中的作用[J].世界林业研究, 2017(2): 26-29.
[11]" 李运婷,宗秀虹,张华雨,等.钝叶柃不同性别植株花期叶片内源激素含量的变化[J].园艺学报, 2016, 43(7): 1411-1418.
[12]" 盛云燕,刘识,李文滨,等.与甜瓜性别分化相关植物激素生物合成途径分析[J].农业生物技术学报, 2012, 20(7): 791-798.
[13]" 李进,杨荣萍,洪明伟,等.石榴完全花与不完全花的内源激素变化研究[J].云南农业大学学报,2015,30(6):986-990.
[14]" 张玲玲.苦瓜性别分化的形态学及生理基础研究[D].南宁:广西大学,2006.
[15]" 王子坚.青钱柳性别分化的相关因素研究[D].南昌:江西农业大学,2013.
[16]" 董硕.核桃雌雄性别分化生理特性研究[D].保定:河北农业大学,2008.
[17]" Ma H, Depamphilis C. The ABCs of floral evolution[J]. Cell, 2000, 101(1): 5-8.
[18]" Sharma B, Kramer E M. Aquilegia B gene homologs promote petaloidy of the sepals and maintenance of the C domain boundary[J]. Evolution Development, 2017(8): 22.
[19]" Yamada T, Yokota S, Hirayama Y, et al. Ancestral expression patterns and evolutionary diversification of YABBY genes in angiosperms[J]. Plant Journal, 2011, 67(1): 26-36.
[20]nbsp; Tanaka W, Toriba T, Ohmori Y, et al. The YABBY gene TONGARI-BOUSHI1 is involved in lateral organ development and maintenance of meristem organization in the rice spikelet[J]. Plant Cell, 2012, 24(1), 80-95.
[21]" Fourquin C, Primo A, Martinez-Fernandez I, et al. The CRC orthologue from Pisum sativum shows conserved functions in carpel morphogenesis and vascular development[J]. Annals of Botany, 2014, 114(7): 1535-1544.
[22]" Brown R H, Nickrent D L, Gasser C S. Expression of ovule and integument-associated genes in reduced ovules of Santalales[J]. Evolution Development, 2010, 12(2): 231-240.
[23]" Villanueva J M, Broadhvest J, Hauser B A, et al. INNER NO OUTER regulates abaxial-adaxial patterning in Arabidopsis ovules[J]. Genes amp; Development, 1999(13): 3160-3169.
[24]" Rienzo V, Imanifard Z, Mascio I, et al. Functional conservation of the grapevine candidate gene INNER NO OUTER for ovule development and seed formation[J]. Horticulture Research, 2021(8): 29.
[25]" Skinner D J, Brown R H, Kuzoff R K, et al. Conservation of the role of INNER NO OUTER in development of unitegmic ovules of the Solanaceae despite a divergence in protein function[J]. BMC Plant Biology, 2016, 16(1): 143.
[26]" Lora J, Hormaza J I, Herrero M. Transition from two to one integument in Prunus species: expression pattern of INNER NO OUTER(INO), ABERRANT TESTA SHAPE(ATS) and ETTIN(ETT)[J]. New Phytologist, 2015(208): 584-595.
[27]" Lora J, Hormaza J I, Herrero M, et al. Seedless fruits and the disruption of a conserved genetic pathway in angiosperm ovule development[J]. Proceedings of the National Academy of Sciences of the United States of America, 2011(108): 5461-5465.
[28]" Jia D D, Chen L G, Yin G M, et al. Brassinosteroids regulate outer ovule integument growth in part via the control of INNER NO OUTER by BRASSINOZOLE-RESISTANT family transcription factors[J]. Journal of Integrative Plant Biology, 2020, 62(8): 1093-1111.
[29]" Huang Z J, Van Houten J, Gonzalez G, et al. Genome-wide identification, phylogeny and expression analysis of SUN, OFP and YABBY gene family in tomato[J]. Molecular Genetics and Genomics, 2013(288): 111-129.
[30]" Morel P, Heijmans K, Ament K, et al. The foral C-lineage genes trigger nectary development in Petunia and Arabidopsis[J]. Plant Cell, 2018(30): 2020-2037.
[31]" Ezura K, Ji-Seong K, Mori K, et al. Genome-wide identifcation of pistil-specifc genes expressed during fruit set initiation in tomato (Solanum lycopersicum)[J]. PLoS One, 2017, 12(7).
[32]" Phukela B, Geeta R, Das S, et al. Ancestral segmental duplication in Solanaceae is responsible for the origin of CRCa CRCb paralogues in the family[J]. Molecular Genetics and Genomics, 2020(295): 563-577.
[33]" Breuilbroyer S, Trehin C, Morel P, et al. Analysis of the Arabidopsis superman allelic series and the interactions with other genes demonstrate developmental robustness and joint specification of male-female boundary, flower meristem termination and carpel compart mentalization[J]. Ann Bot, 2016, 117(5): 905-923.
[34]" J sik J, Bokor B, Stuchl k S, et al. Effects of auxins on PINFORMED2 (PIN2) dynamics are not mediated by inhibiting PIN2 endocytosis[J]. Plant Physiol, 2016, 172(2): 1019-1031.
[35]" Favaro R, Pinyopich A, Battaglia R, et al. MADS-box protein complexes control carpel and ovule development in Arabidopsis[J]. Plant Cell, 2003(15): 2603-2611.
[36]" Pinyopich A, Ditta G S, Savidge B, et al. Assessing the redundancy of MADS-box genes during carpel and ovule development[J]. Nature, 2003(424): 85-88.
[37]" Angenent G C, Franken J, Busscher M, et al. A novel class of MADS box genes is involved in ovule development in petunia[J]. Plant Cell, 1995(7): 1569-1582.
[38]" Dreni L, Kater M M. MADS reloaded:evolution of the AGAMOUS subfamily genes[J]. New Phytologist, 2014, 201(3): 717-732.
[39]" Yamada K, Saraike T, Shitsukawa N, et al. Class D and B (sister) MADS-box genes are associated with ectopic ovule formation in the pistil-like stamens of alloplasmic wheat (Triticum aestivum L.)[J]. Plant Mol Biol, 2009(71): 1-14.
[40]" 陈利娜,张杰,牛娟,等.石榴花发育相关基因PgAGL11的克隆及功能验证[J]. 园艺学报,2017,44 (11):2089-2098.
[41]" Brown R H, Nickrent D L, Gasser C S. Expression of ovule and integument-associated genes in reduced ovules of Santalales[J]. Evolution Development, 2010, 12 (2): 231-240.
[42]" Skinner D J, Gasser C S. Expression-based discovery of candidate ovule development regulators through transcriptional profiling of ovule mutants[J]. BMC Plant Biology, 2009(9): 29.
[43]" Brambilla V,Kater M,Colombo L. Ovule integument identity determination in Arabidopsis. Plant Signaling Behavior,2008,3 (4):246–247.
[44]" Yamada T,Sasaki Y,Hashimoto K,et al. CORONA,PHABULOSA and PHAVOLUTA collaborate with BELL1 to confine WUSCHEL expression to the nucellus in Arabidopsis ovules[J]. Development, 2016, 143 (3):422–426.
[45]" Brambilla V,Battaglia R,Colombo M,et al. Genetic and molecular interactions between BELL1 and MADS-box factors support ovule development in Arabidopsis[J]. Plant Cell,2007, 19 (8):2544–56.
[46]" Bartel D P. MicroRNAs: genomics, biogenesis, mechanism, and function[J]. Cell, 2004(116): 281-297.
[47]" Voinnet O. Origin, biogenesis, and activity of plant microRNAs[J]. Cell, 2009, 136(4): 669-687.
[48]" Reinhart B J, Weinstein E G, Rhoades M W, et al. MicroRNAs in plants[J]. Genes amp; Development, 2002, 16(13): 1616-1626.
[49]" Khraiwesh B, Zhu J K, Zhu J H. Role of miRNAs and siRNAs in biotic and abiotic stress responses of plants[J]. Biochimica et Biophysica Acta(BBA)- Gene Regulatory Mechanisms, 2012, 1819(2):137-148.
[50]" Zhang X, Henderson I R, Lu C, et al. Role of RNA polymerase IV in plant small RNA metabolism[J]. Proceedings of the National Academy of Sciences of the United States of America, 2007, 104(11): 4536-4541.
[51]" 陈利娜. 石榴花雌蕊败育相关microRNAs发掘与pg-miR166a-3p调控雌蕊发育的功能分析[D].郑州:中国农业科学院郑州果树研究所,2020.

