
摘" 要:为明确甜樱桃绿变植原体的分类地位,通过对表现绿变症状的甜樱桃感病植株总DNA进行16S rRNA基因、rp基因和tuf基因的PCR扩增、克隆及序列分析。结果表明,甜樱桃绿变植原体16SrRNA基因片段大小为1 248 bp,与枣疯植原体(AB052876)聚为一簇,且相似系数为1.00,应同属于16SrⅤ-B亚组。基于rp基因系统进化分析表明,甜樱桃绿变植原体与枣疯植原体JWB(AY197681)聚为一簇,属于rpV-C亚组。基于tuf基因系统进化分析显示,甜樱桃绿变植原体与枣疯植原体JWB-XFDO(GU968759)等聚为一簇,属于16SrⅤ组。明确了甜樱桃绿变植原体的分类,为泰安地区病害检测、诊断以及科学防控提供依据。
关键词:甜樱桃;植原体;16SrRNA基因;rp基因;tuf基因
中图分类号:" S662.5" 文献标识码:" A
文章编号:" 1002-2910(2024)05-0012-04
收稿日期:2024-02-23
基金项目:兵团特色果树生产工程实验室开放课题(FE202001);兵团财政科技计划资助(2019DA001, 2020DA003)。
*通信作者:朱天生(1974-),男,甘肃庄浪人,教授,从事植物病理学研究。E-mail:ztszky@163.com
作者简介:陈金霄(1999-),女,山东东营人,在读硕士研究生,研究方向为植物病理学。E-mail:1953421366@qq.com
Molecular detection and identification of sweet cherry virescence phytoplasma
CHEN Jinxiao1,2,DONG Xiaoxu2,ZHU Tiansheng1*,GAO Rui2,WANG Jie2
(1. College of Plant Science, Tarim University/Joint Laboratory of Integrated Control of Agricultural Pests in Southern Xinjiang Production and Construction Corps/National-Local Joint EngineeringLaboratory for High- yield and" High-quality Cultivation and Deep Processing of South Xinjiang Regional SpecialFruits, Alar, "Xinjiang 843300,China; 2. Shandong Institute of Pomology, Taian, Shandong 271000,China)
Abstract:To confirm phytoplasma infection,samples of sweet cherry(Prunus aviumL.)plants showing virescencesymptom were collected from an orchard in Taian. Total DNAs were extracted from symptomatic and asymptomatic plants for PCR amplification. A 16SrDNA fragment of 1 248 bp in length were amplified from diseased cherry tissue,but not from healthy plant,using universal primers for phytoplasmal 16SrRNA gene. The similarity coefficient between the SCHV and the 16SrV-B subgroup ofjujube witches-broomphytoplasma (AB052876) is 1.00. Phylogenetic analysis based on rpgenes revealed that SCHVbelonged to rpV-Csubgroup. Sequence analysis indicated the tufgene ofSCHVwas clustered with jujube witches-broomphytoplasma JWB-XFDO (GU968759), belonging to the 16SrⅤ group. In conclusion, this study clarified the classification of sweet cherry virescence phytoplasma isolated from Taian, providing a foundation for local disease detection, diagnosis, and scientific control.
Key words:sweet cherry; virescence phytoplasma; 16SrRNA gene; rpgene; tufgene
植原体是一类无细胞壁、不能人工培养的原核生物,一般表现为球形、椭圆形、长杆形等多态不规则形状[1]。植原体主要依靠叶蝉和飞虱等从韧皮部取食的刺吸式昆虫传播,也可通过菟丝子寄生或人工嫁接的方式传播。植原体侵染樱桃能够引起植株花变叶、花变绿、丛枝、生长衰退、黄化等症状,发病严重时2~5年内死亡[2,3]。国外对植原体侵染樱桃引起的病害报道较多,主要有16SrI组植原体引起的樱桃花变叶病、16SrII、16SrIII、16SrXII-A和16SrX组植原体引起X-病[4]、樱桃衰退病[5]、樱桃致病黄化[6]和甜樱桃带化病[7]等。目前,国内发现的樱桃植原体病害主要有樱桃致死黄化[8]、樱桃丛枝病[9]、樱桃花变绿病[10]、中国樱桃花变叶病[11]和樱桃衰退病[12]等,分别由16SrI、16SrIII、16SrⅤ组植原体引起。山东省甜樱桃植原体病害的发生逐年加重,主要有甜樱桃丛枝病和樱桃花变绿病,在部分地区对甜樱桃产业的发展产生严重影响。
本研究利用分子生物学技术,对泰安市樱桃园内采集到的甜樱桃感病样品进行植原体检测,明确了分类,为进一步制定有效的防控措施提供了理论依据。
1" 材料与方法
1.1试验材料
表现绿变症状的甜樱桃样品及健康对照样品均采自山东省泰安市泰山区甜樱桃种植区内;PCR产物回收试剂盒、标准分子量Marker、Taq DNA聚合酶等购自南京诺唯赞生物科技股份有限公司;一步法植物DNA提取试剂盒(多糖多酚)购自北京诺贝莱生物科技有限公司;引物由上海铂尚生物技术有限公司合成;测序由生工生物工程(上海)股份有限公司进行。
1.2试验方法
1.2.1" 总DNA的提取。利用一步法植物DNA提取试剂盒分别提取表现绿变症状的甜樱桃及健康对照样品的总DNA。电泳检测所提取DNA完整性,于–20 ℃保存备用。
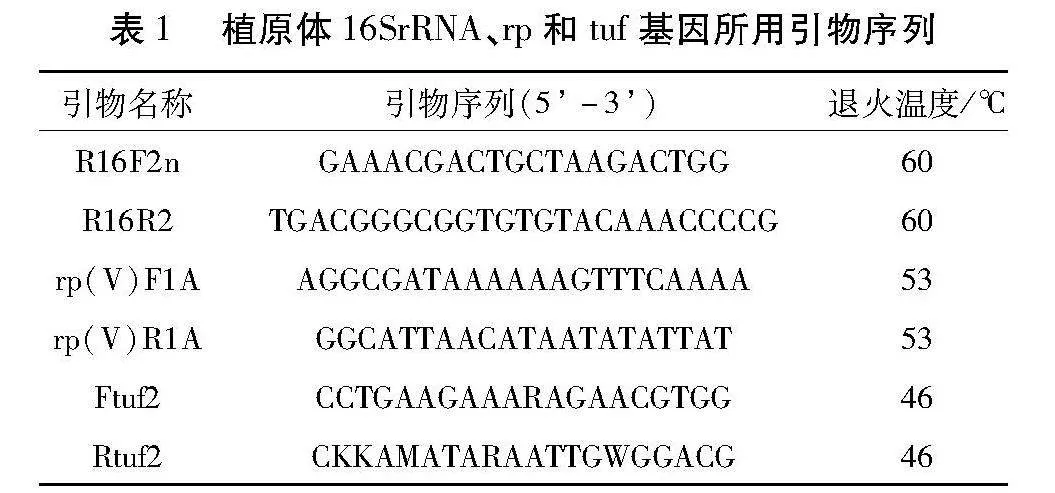
1.2.2甜樱桃绿变植原体16SrRNA基因、rp基因及tuf基因的PCR扩增。以提取的感病样品及健康对照的总DNA为模板,用引物R16F2n/R16R2对样品进行直接扩增。扩增条件:95 ℃ 3 min;95 ℃ 15 s,60 ℃ 15 s,72 ℃ 90 s,35个循环;72 ℃ 10 min。以引物rp(V)F1A/rp(V)R1A基因进行直接扩增。扩增条件:95 ℃ 3 min;95 ℃ 15 s,53 ℃ 15 s,72 ℃ 90 s,35个循环;72 ℃ 10 min。根据NCBI上16SrⅤ组tuf序列设计引物Ftuf2/Rtuf2对tuf基因进行直接扩增。扩增条件:95 ℃ 3 min;95 ℃ 15 s,46 ℃ 15 s,72 ℃ 90 s,35个循环;72 ℃ 10 min。所有引物序列具体如表1所示。
1.2.3" PCR产物的克隆与序列分析。将PCR产物纯化后,与pCE2 TA载体连接,连接产物转化大肠杆菌Trans1-T1感受态细胞,提取质粒,将PCR和酶切鉴定为阳性的重组质粒测序。
利用SeqMan软件对获得的序列进行拼接,在NCBI中对获得的基因序列采用Blast在线对比获取同源序列,下载植原体不同组及亚组的代表株系相关序列,采用MEGA-X软件[16]对所得到的核苷酸序列与GenBank中已下载的相关株系相应基因的核苷酸序列构建系统进化树。
利用植原体分类鉴定在线工具iPhyClassifier(http: / /plantpathology.ba.ars.usda.gov /cgi-bin / resource /iphyclassifier.cgi)进行相关植原体株系候选种的确定和基于相似系数分析的16Sr组或亚组的确定[17]。
2" 结果与分析
2.1甜樱桃绿变病株的症状表现
感病的甜樱桃植株花瓣变为明显的绿色,新生叶片变小、皱缩,果实变为僵果,不能成熟,严重时植株枯死(图1)。
2.2 甜樱桃绿变植原体16SrRNA克隆及序列分析
从表现绿变症状的甜樱桃中提取的总DNA均扩增到长度约为1.2 kb的16SrRNA基因片段,与预期大小相符,健康植株中未扩增出特异条带,说明表现绿变症状的樱桃植株中存在植原体。将此植原体分离物命名为甜樱桃绿变植原体(SCHV)。
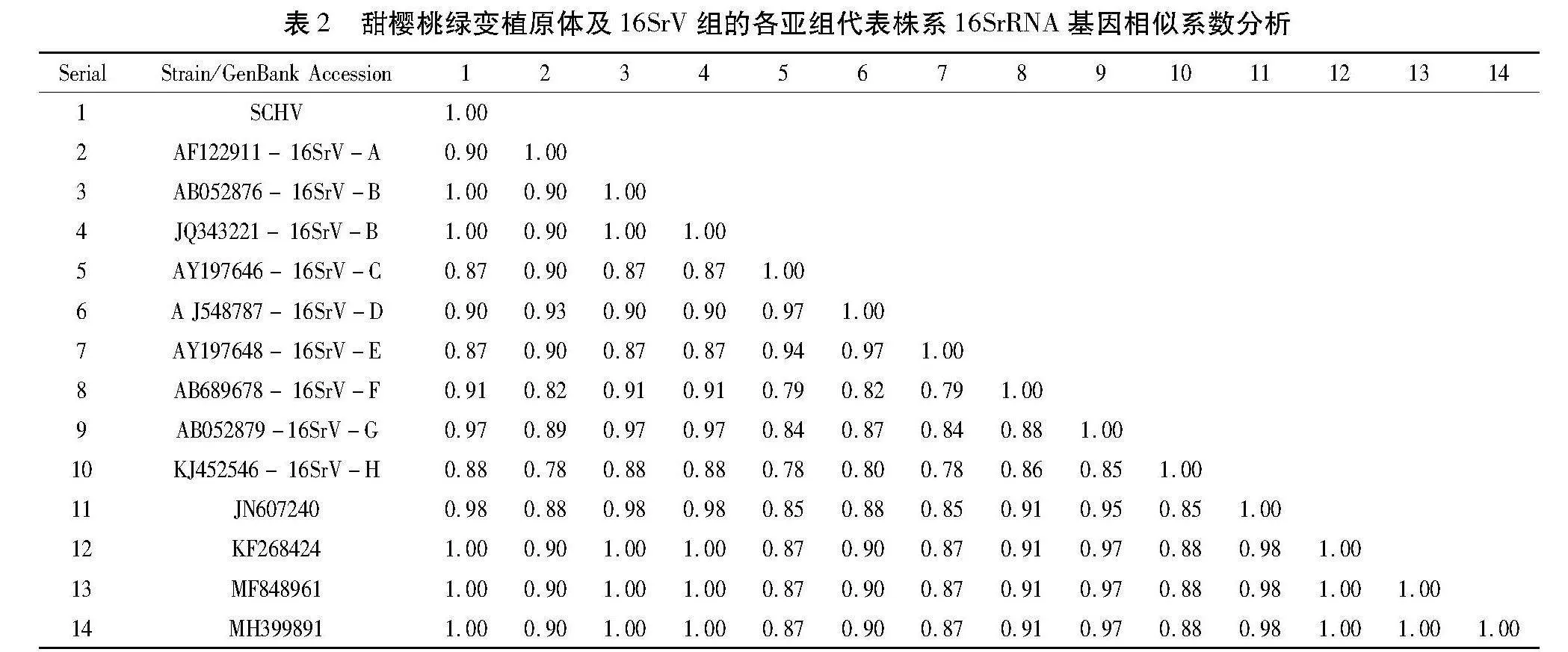
甜樱桃绿变植原体的16S rRNA基因含有1 248个核苷酸,G + C的含量为45.75%。将该分离物与GenBank中21个植原体分离物的16SrRNA基因进行比对和系统进化分析。
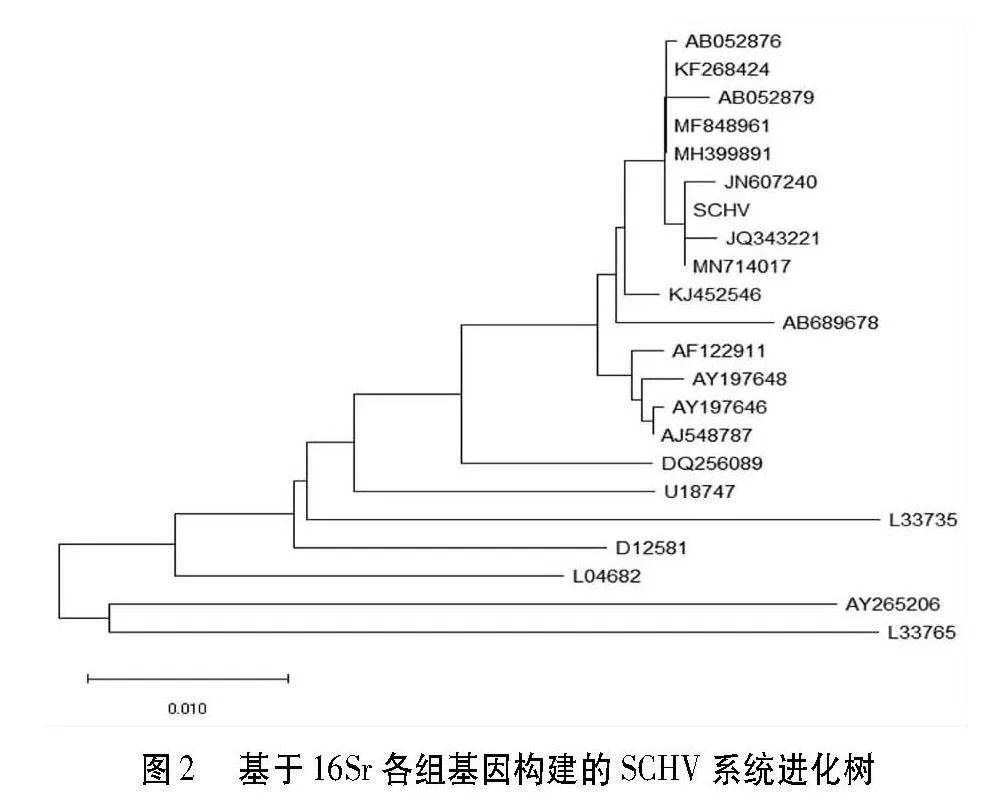
结果表明,SCHV与枣疯病植原体(AB052876)、甜樱桃绿变植原体(MF848961)、中国樱桃花变叶植原体(MH399891)和樱桃绿变植原体ChV-Mn分离物(JN607240)的序列一致率均为99.8%。从系统进化树中可以看出,SCHV与甜樱桃绿变植原体(MF848961)、樱桃绿变植原体ChV-Mn分离物(JN607240)和枣疯植原体(AB052876)聚为一簇,同一16SrⅤ-B亚组(图2)。
根据植原体鉴定在线工具iPhyClassifier进一步鉴定,确定甜樱桃绿变植原体(SCHV)属于16SrV-B亚组(表2)。
2.4 甜樱桃绿变植原体rp基因克隆及序列分析
用rp基因扩增的PCR产物测序结果表明甜樱桃绿变植原体rp基因含有1 222个核苷酸,G + C的含量为27.82%。将甜樱桃绿变植原体(SCHV)的rp基因与GenBank中19个rpV组各亚组植原体分离物的rp基因序列进行一致率比对和系统进化分析。
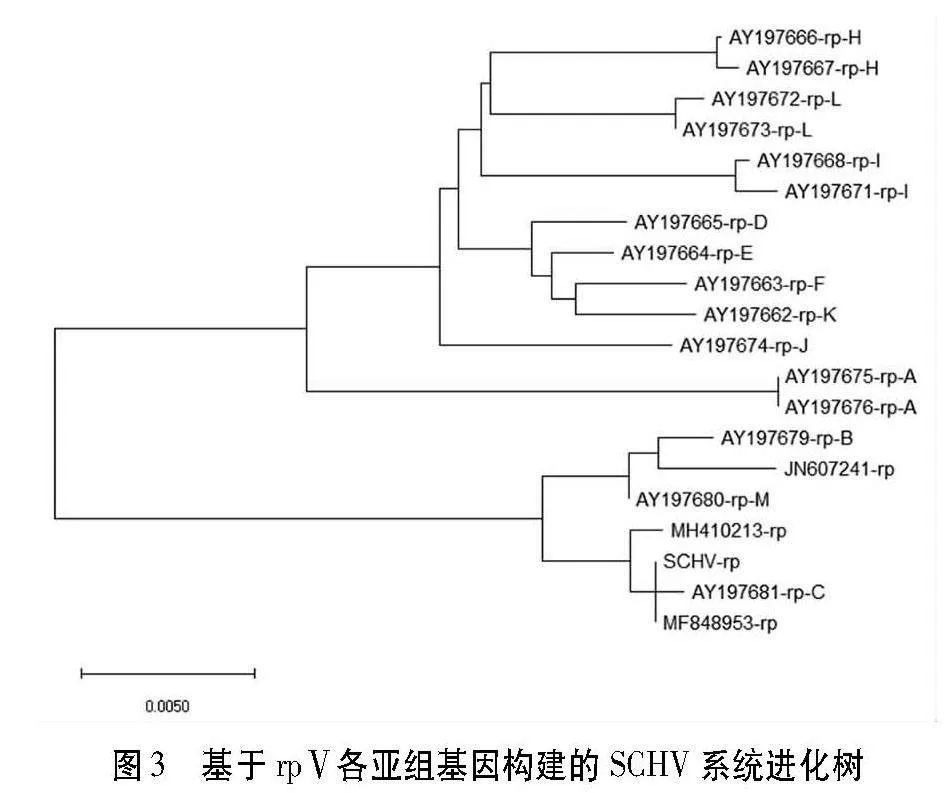
结果表明,甜樱桃绿变植原体(SCHV)与甜樱桃绿变植原体SCV-XL-2014(MF848953)和枣疯植原体(AY197681)的序列一致率最高为99.8%。而与其他组植原体一致率均小于90%。系统进化分析也表明,SCHV分离物与属于rpV-C亚组的甜樱桃绿变植原体SCV-XL-2014(MF848953)、枣疯植原体JWB(AY197681)聚为一簇(图3),表明甜樱桃绿变植原体(SCHV)分离物属于rpV-C亚组。
2.5甜樱桃绿变植原体tuf基因克隆及序列分析
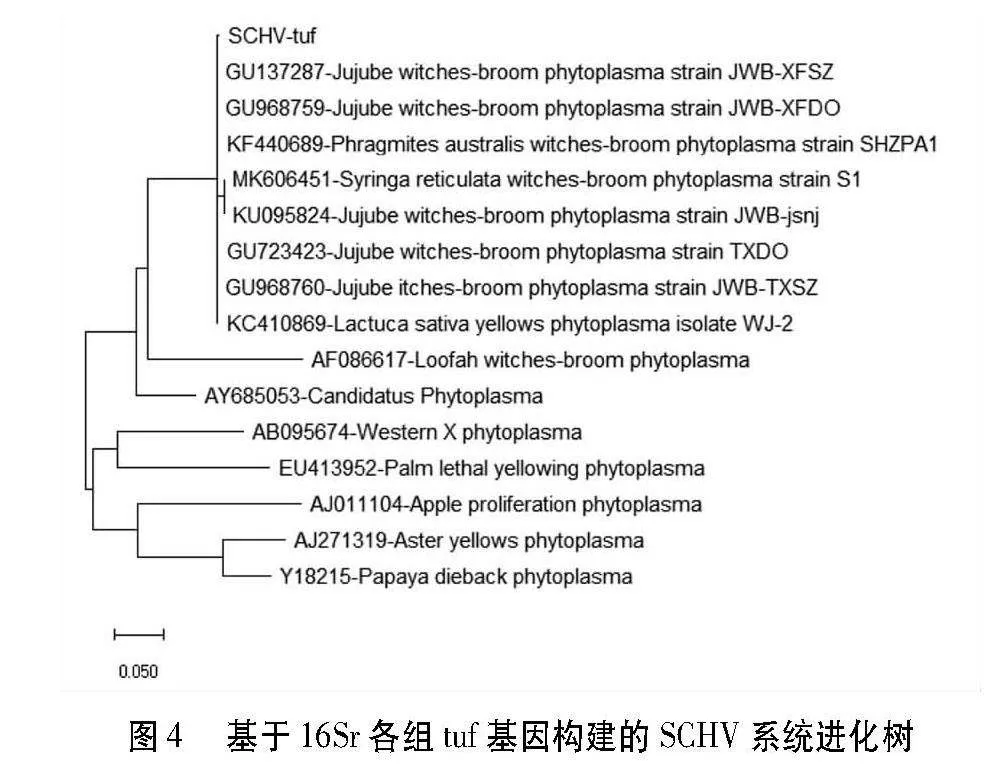
用tuf基因扩增的PCR产物测序结果表明甜樱桃绿变植原体(SCHV)的tuf基因含有828个核苷酸,其中G + C的含量为32.97%。将SCHV的tuf基因与GenBank中15个16Sr组各植原体分离物的tuf基因序列进行一致率比对和系统进化分析。结果表明,与枣疯植原体(CP025121)一致率最高,为99.8%,与枣疯植原体JWB-XFSZ(GU137287)和枣疯植原体JWB-TXSZ(GU968760)tuf基因序列一致率为99.7%;而与其他组植原体一致率均小于99%。系统进化分析也表明,SCHV与属于16SrV组的枣疯植原体JWB-XFSZ(GU137287)、枣疯植原体JWB-XFDO(GU968759)等聚为一簇(图4),SCHV分离物属于16SrV组。
3" 小结及讨论
国内1982年首次发现致死黄化植原体,可使樱桃叶片黄化,樱桃果实变小变少并且不能发育成熟,严重的情况下,发病2~5年后整株植株死亡[8]。随后21世纪初陆续有关于樱桃植原体病害被报道,2007年首次在烟台地区发现樱桃花变绿植原体,被侵染的樱桃植株表现为花瓣变成绿色,节间短,不育等症状[10]。与樱桃花变绿植原体症状相似的是樱桃花变叶植原体的症状,症状表现为花器官被叶片代替,变成绿色。
山东省樱桃植原体病害主要是樱桃花变绿植原体和樱桃丛枝植原体,王甲威等对山东泰安、临沂地区的甜樱桃丛枝病株内检测到了16SrV-B亚组植原体[13]。本研究在表现为绿变的甜樱桃上检测到同为16SrV-B亚组的植原体,而在烟台地区表现花变绿症状的樱桃上则检测到了16SrI-B亚组植原体。
虽然国内对樱桃植原体病害的报道极少,但是仍有相关报道表明樱桃植原体病害逐渐成为阻遏樱桃产业发展的重要因素之一。近些年有关山东省樱桃植原体病害被陆续报道,樱桃花变叶、花变绿、丛枝等病害发生日渐严重,使樱桃产量显着降低。到目前为止,虽然还没有相关报道表明如何才能有效地防治樱桃植原体病害,但通过农业防治策略,可以在一定程度上减少植原体的传播和蔓延[14]。
参考文献:
[1]" 刘仲健.植原体病理学[M]. 北京:中国林业出版社, 1999.
[2]" Bai X,Zhang J,Ewing A,et al. Living with genome instability: the adaptation of phytoplasmas to diverse environments of their insect and plant hosts[J]. Journal of Bacteriology, 2006 (188): 3682-3696.
[3]" Carraro L,Osler R,Loi N,et al. Transmission characteristics of the clover phyllody agent by dodder[J]. Journal of Phytopathology, 2010, 133(1), 15-22.
[4]" GONZáLEZ F,ZAMORANO A,PINO A M,et al. Identification of phytoplasma belonging to X-disease group in cherry in Chile[J]. Bulletin of Insectology,2011(64): S235-S236.
[5]" VALIUNAS D,JOMANTIENE R,IVANAUSKAS A,et al. First report of a new phytoplasma subgroup,16SrIII- T,associated with decline disease affecting sweet and sour cherry trees in Lithuania[J]. Plant Disease,2009,93(5): 550.
[6]" Fránová, Jana, Lenz O ,Pibylová, et al.Candidatus Phytoplasma asteris andCandidatus Phytoplasma malistrains infecting sweet and sour cherry in the Czech Republic[J]. Journal of Phytopathology,2018,166(1): 59-66.
[7]" 陶玲珠, 黄习军, 张建英, 等. 从以色列引进的樱桃树苗中检出樱桃带化病[J]. 植物保护, 1996(3):46.
[8]" 朱水方, 舒秀珍, 何光烈, 等.樱桃致死黄化病病原研究[J].植物病理学报,1992,22(1):25-28.
[9]" 郑晓慧, 朱国翱, 王连春, 等.樱桃花变绿病植原体的分子鉴定[J].植物病理学报,2012,42(5):546-550.
[10]" 王甲威, 朱东姿, 魏海蓉, 等. 甜樱桃丛枝病的形态及分子鉴定[J]. 果树学报,2014,31(S1):153-158.
[11]" 高瑞, 杨淑珂, 王洁, 等.中国樱桃花变叶病相关植原体的分子检测及鉴定[J].园艺学报,2019,46(7): 1249-1256.
[12]" WANG J W,ZHU D Z,LIU Q,et al. First report of sweet cherry virescence disease in China and its association with infection by aCandidatus Phytoplasma ziziphi-related strain[J]. Plant Disease,2014,98(3): 419.
[13]" 王甲威, 朱东姿, 洪坡, 等. 甜樱桃矮化丛枝形整形技术[J]. 落叶果树,2020,52(3):52-53.
[14]" 穆雪, 赵洋, 李春艳, 等. 国内外樱桃植原体(Phytoplasma)病害研究进展[J]. 果树学报, 2019,36(12):1754-1762.

