中图分类号:S663.1 文献标志码:A 文章编号:1002-2910(2025)02-0038-05
Study on the effects of colchicine-induced polyploidization in Shine Muscat grapes
ZHANGShihao, SUNXinru,FENG Haonan,YAO Yuxin* (College of Horticulture Science and Engineering, Shandong Agricultural University, Taian,Shandong271018,China)
Abstract: The shoot segments of Shine Muscat grapes were used as materials, and 0 . 2 % 0 . 4 % , 0 . 8 % ,and 1 . 2 % colchicine solutions were applied to treat the shoot with different times by the cotton immersion and soaking methods, the study was aimed to obtain the tetraploid grapes. The results showed that soaking grape branch segments in 0 . 4 % colchicine ( 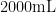 and 1 % dimethyl sulfoxide ( 2 0 0 m L )for 6 days resulted in the greatest mutagenic effect, with a lethal rate of 5 0 . 0 0 % (20号 and a mutation rate of 6 . 6 0 % , respectively. A total of 12 tetraploid and 2 mixed polyploid plants of the Sunshine Rose were obtained; The cotton soaking method with 1 . 2 % colchicine 2 0 0 m L + 1 % dimethyl sulfoxide 2 0 m L cotton soaked grape branch segments for 6 days showed the greatest mutagenic effect, with a lethal and mutation rate of 2 5 . 0 0 % and 6 . 0 0 % , respectively.
and 1 % dimethyl sulfoxide ( 2 0 0 m L )for 6 days resulted in the greatest mutagenic effect, with a lethal rate of 5 0 . 0 0 % (20号 and a mutation rate of 6 . 6 0 % , respectively. A total of 12 tetraploid and 2 mixed polyploid plants of the Sunshine Rose were obtained; The cotton soaking method with 1 . 2 % colchicine 2 0 0 m L + 1 % dimethyl sulfoxide 2 0 m L cotton soaked grape branch segments for 6 days showed the greatest mutagenic effect, with a lethal and mutation rate of 2 5 . 0 0 % and 6 . 0 0 % , respectively.
Key words: grape; Shine Muscat; colchicine; induce; polyploidy
多倍体作物具有产量高、器官巨大、抗病抗逆能力强等特性,生产上有广泛推广应用[1。多倍体育种受许多育种家的青睐,其中秋水仙素(Colchicine)诱导法较常见。20世纪50年代,Dermen利用秋水仙素诱导夏葡萄(Vitisaestivalis)、欧洲葡萄( V . vinifera)和圆叶葡萄(V.rotundifolia),获得了四倍体或嵌合体[2]。吴红[3]、集贤4用秋水仙素分别处理维多利亚、优无核葡萄的种子和试管苗,均获得一定数量的四倍体植株。
秋水仙素诱导多倍体时其浓度和处理时间是影响诱变效果的关键因素。有研究表明,较有效的秋水仙素浓度为 0 . 0 0 1 % ~ 1 % ,诱导果树多倍体的时间是 4 ~ 7 2 0 h 。一般通过设置不同的秋水仙素浓度和处理时间,探讨诱导果树多倍体的最优浓度与时间组合[5]。
阳光玫瑰葡萄是以安芸津21号与白南杂交选育而成的二倍体欧美杂交种品种[]。为提升其果实品质及为葡萄遗传改良提供新的亲本材料,笔者于2023年3~12月在葡萄日光温室大棚内进行试验,以秋水仙素对阳光玫瑰二倍体枝条进行处理,以获得四倍体种质。
1材料与方法
1.1 试验材料
以阳光玫瑰葡萄带芽茎段为试材,茎段为冬季埋土防寒的葡萄枝条,处于休眠末期或刚萌动状态。处理前将枝条剪成长 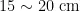 、带2个芽的茎段。
、带2个芽的茎段。
试验中所用药品为秋水仙素粉末,纯度 9 9 % HPLC级别,规格为 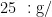 瓶,阿拉丁生化科技股份有限公司生产;化学渗透剂二甲基亚砜(DMSO),规格为 5 0 0 m L/ 瓶;细胞裂解液,Sigma-Aldrich生产;PI染色液;超纯水。
瓶,阿拉丁生化科技股份有限公司生产;化学渗透剂二甲基亚砜(DMSO),规格为 5 0 0 m L/ 瓶;细胞裂解液,Sigma-Aldrich生产;PI染色液;超纯水。
试验仪器包括离心机、高压灭菌锅、贝克曼CytoFLEX流式细胞仪、倍性分析试剂盒CyStainTMUV Precise。
1.2秋水仙素诱变液配制
将秋水仙素粉末与超纯水按照 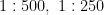 、1 : 1 2 5 , 3 : 2 5 0 的比例分别配置适量的 0 . 2 % , 0 . 4 % 、0 . 8 % 、 1 . 2 % 秋水仙素溶液,将4个浓度的秋水仙素溶液分别与 1 % 的渗透剂二甲基亚砜(DMSO)以1 0 : 1 的比例混合,以混合液处理葡萄枝段。
、1 : 1 2 5 , 3 : 2 5 0 的比例分别配置适量的 0 . 2 % , 0 . 4 % 、0 . 8 % 、 1 . 2 % 秋水仙素溶液,将4个浓度的秋水仙素溶液分别与 1 % 的渗透剂二甲基亚砜(DMSO)以1 0 : 1 的比例混合,以混合液处理葡萄枝段。
配制裂解液:参考Veylder裂解液配制方法[7]。每 1 0 0 m L 超纯水中加入 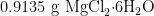 、
、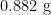 柠檬酸钠、 0 . 4 1 8 g 3 - ( N- 吗啉基)丙磺酸、2 0 0 μ L 曲拉通X-100(
柠檬酸钠、 0 . 4 1 8 g 3 - ( N- 吗啉基)丙磺酸、2 0 0 μ L 曲拉通X-100( 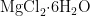 提供
提供 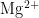 离子,用于维持酶的活性或稳定核酸结构;柠檬酸钠螯合
离子,用于维持酶的活性或稳定核酸结构;柠檬酸钠螯合 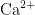 、
、 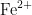 等金属离子,抑制金属依赖的核酸酶,防止DNA降解;3-(N-吗啉基)丙磺酸维持裂解液的pH稳定,确保反应条件适宜;曲拉通X-100破坏细胞膜结构,促进细胞裂解,释放细胞内含物)。
等金属离子,抑制金属依赖的核酸酶,防止DNA降解;3-(N-吗啉基)丙磺酸维持裂解液的pH稳定,确保反应条件适宜;曲拉通X-100破坏细胞膜结构,促进细胞裂解,释放细胞内含物)。
1.3 试验设计
设置2种葡萄枝蔓诱变处理方法,一是秋水仙素诱变液浸泡法,二是秋水仙素液棉浸渍法。将阳光玫瑰葡萄二倍体一年生枝蔓剪成长 1 5 ~ 2 0 c m 的带芽枝段,进行药剂诱变处理。
1.3.1秋水仙素浸泡诱变法设置2个变量,变量1,处理浓度,设置 0 . 2 % 和 0 . 4 % 2 个梯度;变量2,处理时间,设置3d和6d2个时间,记作4个处理,即 0 . 2 % 处理3d、 0 . 2 % 处理6d、 0 . 4 % 处理3d、 0 . 4 % 处理6d,分别记作T1,T2,T3,T4。以喷清水作为对照(CK)。各处理和清水对照分别30个枝条。
于3月7日将阳光玫瑰葡萄带芽茎段用小刀进行刻芽处理后浸泡于不同浓度的秋水仙素诱变液中。浸泡结束时,取出茎段用无菌水清洗3~4次,然后将茎段扦插入大棚苗床培养管理。
1.3.2秋水仙素棉浸诱变法设置2个变量,变量1,处理浓度,设置 0 . 8 % 和 1 . 2 % 2 个梯度;变量2,处理时间,设置5d和 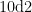 个时间,记作4个处理,即 0 . 8 % 处理 5 d, 0 . 8 % 处理 1 0 d, 1 . 2 % 处理 5 d, 1 . 2 % 处理 1 0 d ,分别记作M1,M2,M3,M4。以喷清水作为对照(CK)。各处理100个枝条,清水对照30个枝条。
个时间,记作4个处理,即 0 . 8 % 处理 5 d, 0 . 8 % 处理 1 0 d, 1 . 2 % 处理 5 d, 1 . 2 % 处理 1 0 d ,分别记作M1,M2,M3,M4。以喷清水作为对照(CK)。各处理100个枝条,清水对照30个枝条。
3月10日将葡萄带芽茎段用小刀进行刻芽处理后,用双层脱脂棉包裹芽位,再用保鲜膜裹紧,将经过包裹处理的茎段扦插到大棚苗床上。在傍晚或清晨将 0 . 8 % 和 1 . 2 % 秋水仙素诱变液均匀地注入脱脂棉中,注射剂量保证处理芽充分浸泡在药剂中,注射完成后及时覆盖遮阳网,防止秋水仙素见光分解。隔天注射1次,直至枝条开始发芽后解除保鲜膜及脱脂棉,继续在苗床上培养管理。
1.4植株倍性检测
当苗床葡萄插条生长40d后,使用贝克曼CytoFLEX流式细胞仪进行快速倍性鉴定,根据出现的细胞数峰值位置和基因强度Mean值进行倍性的判定。具体方法如下。
在苗床中取长势良好的嫩叶测定倍性。用二倍体的峰值校准流式分析仪,待峰值准确稳定后将所取嫩叶用蒸馏水清洗后放入一次性培养皿中,加入6 0 0 μ L 裂解液(倍性分析试剂盒CyStainTMUVPrecise),用双面刀片垂直于试材下切成颗粒状,再次加入 6 0 0 μ L 裂解液,保证试材充分浸透在溶液里 1 m i n ,以充分提取细胞核。在400目的过滤器中过滤残渣,取 1 . 5 m L 澄清液于离心管中,加入适量的PI染色液,比例为 1 m L 裂解液加入 5 5 μ L PI染色液。静置 1 m i n ,离心后上机检测。根据流式细胞仪检测出的峰值位置判定倍性,筛选出诱变成功且生根的茎段移植到大田中继续观察研究。
2 结果与分析
2.1秋水仙素浸泡法诱导多倍体的效果
如表1,用诱变混合液浸泡葡萄茎段,T1、T2秋水仙素浓度 0 . 2 % 时,诱变3d和6d的致死率分别是 3 . 3 3 % 和 1 0 . 0 0 % ,变异率分别是 0 % 和 3 . 3 3 % :T3、T4秋水仙素浓度在 0 . 4 % 时,诱变3d和6d的致死率分别是 1 3 . 3 3 % 和 5 0 . 0 0 % ,变异率分别是 0 % 和 6 . 6 6 % 。说明诱变混合液浓度一定时,诱变时间是影响诱变效果的关键因素,诱变致死率与变异率均与诱变时间呈正相关。
诱变处理相同的时间,不同浓度的效果不同。处理3d时,T1、T3的时间相同, 0 . 2 % 和 0 . 4 % 秋水仙素诱变液致死率分别是 3 . 3 3 % 和 1 3 . 3 3 % ,变异率分别是 0 % 、 0 % ;处理6d时,T2、T4的时间相同,0 . 2 % 和 0 . 4 % 秋水仙素诱变致死率分别是 1 0 . 0 0 % 和5 0 . 0 0 % ,变异率分别是 3 . 3 3 % 7 6 . 6 6 % 。说明诱变时间一定时,诱变混合浓度是影响诱变效果的关键因素,诱变致死率、变异率均与诱变混合液的浓度呈正相关。
综上,T4( 0 . 4 % 秋水仙素 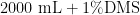 02 0 0 m L 浸泡6d)的诱变效果最大,诱变致死率和变异率分别是 5 0 . 0 0 % 和 6 . 6 6 % 。
02 0 0 m L 浸泡6d)的诱变效果最大,诱变致死率和变异率分别是 5 0 . 0 0 % 和 6 . 6 6 % 。
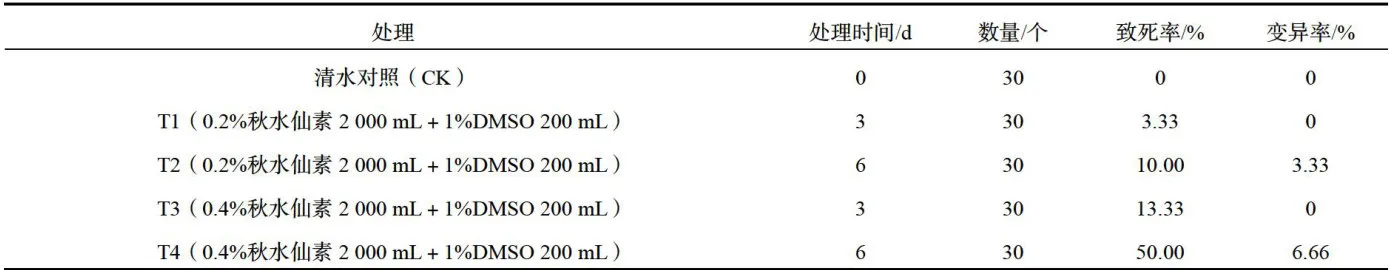 表1秋水仙素浸泡法诱导阳光玫瑰葡萄多倍体的效果
表1秋水仙素浸泡法诱导阳光玫瑰葡萄多倍体的效果
2.2秋水仙素棉浸法诱导多倍体的效果
如表2,对用脱脂棉包裹的茎段注射诱导混合液,处理 Ml 、M2浓度在 0 . 8 % 时,处理5d和 1 0 d 的致死率分别为 1 1 . 0 0 % 和 1 6 . 0 0 % ,变异率分别是0 % 和 2 . 0 0 % ;M3、M4浓度在 1 . 2 % 时,处理5d和1 0 d 的致死率分别是 2 0 . 0 0 % 和 2 5 . 0 0 % ,变异率分别是 3 . 0 0 % 和 6 . 0 0 % 。说明诱变混合液浓度一定时,棉浸法诱变时间成为诱变效果的关键因素,诱变致死率与变异率均与诱变时间呈正相关。诱变处理5d时,M1、M3的时间相同, 0 . 8 % 和 1 . 2 % 的秋水仙素诱变液的诱变致死率分别是 1 1 . 0 0 % 和 2 0 . 0 0 % ,变异率分别是 0 % 、 3 . 0 0 % ;诱变处理10d时,M2、M4的时间相同, 0 . 8 % 和 1 . 2 % 的秋水仙素诱变液的诱变诱变致死率分别是 1 6 . 0 0 % 和 2 5 . 0 0 % ,变异率分别是2 . 0 0 % 、 6 . 0 0 % 。说明诱变时间一定时,诱变混合浓度成为诱变效果的关键因素,诱变致死率、变异率均与诱变混合液的浓度呈正相关。
综上,以M4( 1 . 2 % 秋水仙素 2 0 0 m L+1 % D M S C 02 0 m L 棉浸 1 0 d )的诱变效果最大,诱变致死率和变异率分别是 2 5 . 0 0 % 和 6 . 0 0 % 。
 表2秋水仙素棉浸法诱导阳光玫瑰葡萄多倍体的效果
表2秋水仙素棉浸法诱导阳光玫瑰葡萄多倍体的效果
2.3 葡萄变异植株倍性鉴定结果
对阳光玫瑰二倍体和经秋水仙素诱变液处理的二倍体材料进行倍性分析,根据流式细胞仪出现细胞数峰值的位置和待测样品的基因强度Mean值,比较四倍体Mean值与二倍体Mean值的比值( ≈ 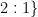 ,判断四倍体及混倍体,结果如图1、图2所示,纵坐标为细胞总数,横坐标为DNA的荧光强度,四倍体峰值在二倍体之后,混倍体在二倍体和四倍体位置均有峰值。Mean值比较结果如表3,混倍体Mean值约1.80,四倍体Mean值约 2 . 0 0 。流式分析仪筛选出14组倍性变异植株,其中12株四倍体和2株混倍体阳光玫瑰。
,判断四倍体及混倍体,结果如图1、图2所示,纵坐标为细胞总数,横坐标为DNA的荧光强度,四倍体峰值在二倍体之后,混倍体在二倍体和四倍体位置均有峰值。Mean值比较结果如表3,混倍体Mean值约1.80,四倍体Mean值约 2 . 0 0 。流式分析仪筛选出14组倍性变异植株,其中12株四倍体和2株混倍体阳光玫瑰。
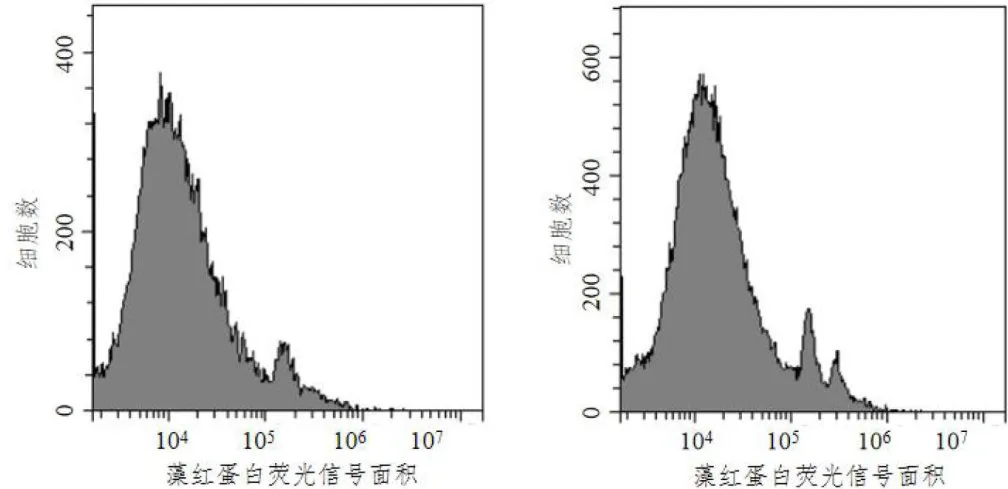 图1二倍体对照(左)与6号混倍体(右)细胞数峰值图
图1二倍体对照(左)与6号混倍体(右)细胞数峰值图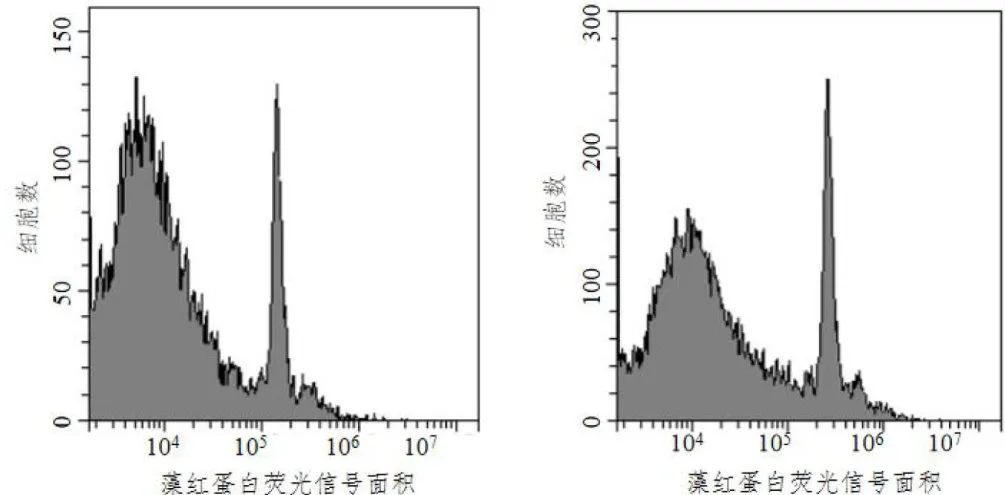 图2二倍体对照(左)与106号四倍体(右)细胞数峰值图
图2二倍体对照(左)与106号四倍体(右)细胞数峰值图
3小结与讨论
秋水仙素可抑制细胞分裂时纺锤体形成,阻碍染色体向细胞两极移动,使染色体数目加倍,形成多倍体细胞。研究证实,借助适宜浓度秋水仙素与处理时间诱导植物多倍体,能够成功培育多倍体植株[7]。采用秋水仙素溶液浸泡法和棉浸法处理二倍体阳光玫瑰葡萄枝段,均可得到一定数量的加倍变异体,随着秋水仙素浓度和处理时间的增加,其致死率升高,这与潘宏兵等[8在石榴、刘牧青等[]在不同葡萄品种上的研究结果一致。
从诱导效果看,浸泡法处理诱导效果较好。当秋水仙素浓度为 0 . 4 % 、处理时间6d时,变异率达6 . 6 6 % ,致死率为 5 0 . 0 0 % 。比棉浸法操作更简便、工作量更小,不过秋水仙素使用量更大。从影响因素分析,浸泡法在 0 . 2 % 和 0 . 4 % 浓度条件下,处理时间对材料的影响程度大于浓度;而棉浸法中,时间与浓度对试材的诱变作用均较为显着。因此,后续试验可增设组培苗、种子等材料,并拓展至其他葡萄品种开展处理研究,进一步完善葡萄秋水仙素诱变体系。
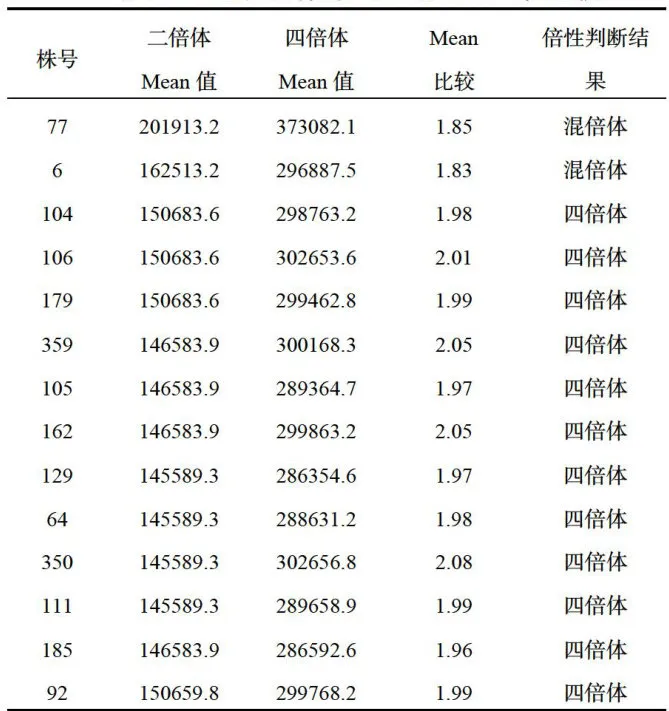 表314株变异体的基因强度Mean值比较
表314株变异体的基因强度Mean值比较
利用秋水仙素进行诱导时出现嵌合体是常见的,随着处理时间和秋水仙素处理浓度的增加而增加[10]。化学渗透剂二甲基亚矾与秋水仙素混合使用会增强其对细胞分裂的抑制作用而大大降低嵌合体的产生[]。本试验利用秋水仙素与二甲基亚砜的混合液处理阳光玫瑰葡萄茎段,共获得了12株四倍体和2株混倍体,数量明显较少,这与张虹等[12]在黑果枸杞萌动种子上的研究结果一致。
葡萄染色体数量较多,不易观察,且工作量大,使用流式细胞仪成功测得阳光玫瑰诱变枝条的倍性,判断并筛选出变异体,可以定量测试植物不同部位细胞中RNA、DNA的含量。与传统的组型分析法染色体计数法相比,该方法能较为迅速准确地鉴定植物倍性,方法简便,精准度较高[13,14],已在猕猴桃[15]、山楂[16]、菊芋[17]等植物上应用并成功测出了植株的倍性。该研究利用流式分析仪成功测得阳光玫瑰诱变枝条的倍性,判断并筛选出变异体。后续将变异体移栽到田间进行性状观察和相关生理指标测定,以获得稳定的多倍体株系,为阳光玫瑰葡萄多倍体育种提供种质资源。
参考文献:
[1]闫爱玲,王慧玲,孙磊,等.未名玫瑰葡萄秋水仙素诱导与鉴定[J]安徽农业科学,2016,44(28):106-108.
[2] DERMENH.Colchiploidyin grape[J].Journal ofHeredity,1954,
45(4): 159-1/2.
[3]吴红,刘争,贾书果,等.秋水仙素诱导维多利亚葡萄试管苗多倍体研究[J].中外葡萄与葡萄酒,2012(1): 2 6 - 2 8 + 3 1
[4]集贤,常永义,李文瑾,等.葡萄优无核试管苗的多倍体诱导[J].甘肃农业大学学报,2010,45(2): 5 8 - 6 2 + 7 8
[5]张美华,李慧敏,莫干辉,等.秋水仙素在诱导我国果树多倍体的应用研究进展[J].农业研究与应用,2023,36(1):7-15.
[6]杨治元,陈哲.阳光玫瑰葡萄规模种植情况调查初报[J].中外葡萄与葡萄酒,2017(1):59-60.
[7]VEYLDER D L.Control of proliferation,endoreduplication anddifferentiationby the ArabidopsisE2Fa-DPa transcription factor[J].EMBOJ,2014,21(6):1360-1368.
[8]潘宏兵,罗玲,冯娟,等.石榴同源四倍体诱导及评价[J].河南农业科学,2020,49(5):111-117.
[9]刘牧青,马岩,谢洁,等.秋水仙素对不同葡萄多倍体诱导的影响[J].中外葡萄与葡萄酒,2024,(1):48-54.
[10]路斌,徐宁伟,李娟娟,等.秋水仙素对杜梨四倍体的诱导及鉴定[J].河北科技师范学院学报,2023,37(4):37-42.
[11]符芳宁.木薯多倍体诱变及后代鉴定研究[D].南宁:广西大学,2018.
[12]张虹,龙宏周,路国栋,等.黑果枸杞多倍体诱导及鉴定[J].核农学报,2017,31(1):59-65.
[13]林丹,李冰冰,赵振利,等.基于流式细胞仪对不同品种泡桐倍性及白花泡桐基因组大小的测定[J].河南农业大学学报,2019,53(3): 3 3 7 - 3 4 2 + 3 9 9
[14]吴雅琴,周锡明,陈龙,等.利用流式细胞术鉴定甜樱桃砧木细胞核DNA含量和染色体倍性[J].果树学报,2014,31(S1):48-52.
[15]罗庆,高建有,李洁维,等.利用流式细胞仪对猕猴桃种质染色体倍性的鉴定[J].生物学杂志,2022,39(6): 6 6 - 7 2 + 9 3
[16]崔金鑫,李月梅,张蕊婧,等.利用流式细胞仪鉴定山楂种质资源的倍性[J].北方园艺,2016(1):84-86.
[17]赵孟良,任延靖,田闵玉,等.基于流式细胞仪鉴定菊芋倍性方法的建立及应用[J].西北农林科技大学学报(自然科学版),2021,49(3):138-146.

