

收稿日期:2023-11-23
DOI:10.19850/j.cnki.2096-4706.2024.05.029
摘" 要:光学相干断层血管造影技术是一种基于运动对比的血管造影方法,尽管采集速度有所提高,但是眼球运动仍然是造成伪影的主要原因。文章描述了一个基于硬件的主动眼底跟踪扫描激光检眼镜系统集成到OCTA系统的方法,在OCTA采集过程中SLO系统也同步启动,同时成像并对SLO图像引用GPU并行处理Frangi滤波和四象限角点匹配的偏移计算方法来进行实时的眼动矫正,可达到消除眼动伪影,视网膜眼底血流结构高精度成像的效果。
关键词:OCTA;眼底跟踪;Frangi滤波;四象限角点匹配
中图分类号:TP391.4" " 文献标识码:A" " 文章编号:2096-4706(2024)05-0133-05
Design of Eye Tracking System Based on OCTA
CEN Yingshan1, HAN Dingan2, WU Nanshou2
(1.School of Mechatronic Engineering and Automation, Foshan University, Foshan" 528225, China;
2.School of Physics and Optoelectronic Engineering, Foshan University, Foshan" 528225, China )
Abstract: Optical Coherence Tomography Angiography (OCTA) technology is a angiography method based on motion contrast. Despite improved acquisition speed, eye movement is still the main cause of artifacts. The paper describes a method for integrating an active fundus tracking Scanning Laser Ophthalmoscope (SLO) system based on hardware into the OCTA system. During the OCTA acquisition process, the SLO system is also synchronously started, and the imaging is performed, and GPU parallel processing Frangi filtering and four-quadrant corner matching offset calculation methods is used for real-time eye movement correction, which can eliminate eye movement artifacts and achieve the effect of high-precision imaging of retinal fundus blood flow structure.
Keywords: OCTA; fundus tracking; Frangi filtering; four-quadrant corner matching
0" 引" 言
光学相干断层血管造影成像(Optical Coherence Tomography Angiography, OCTA)是一种基于运动对比的血管造影方法,作为光学相干层析成像(Optical Coherence Tomography, OCT)技术的扩展[1],是临床诊断眼底情况广泛使用的成像手段,能提供视网膜和脉络膜血液流动的深度分辨图像,其详细程度远远超过了旧形式的成像[2,3],也是鉴定眼科疾病的常用方法。然而,为了获得眼底血管图像,OCTA系统需要连续采集大量数据,采集过程时间也会拉长,在此过程中病人的呼吸及其眼睛的自然眨动都会引进无用的信号,使结果图像产生血管错位和血管重复虚影[4]等问题。目前进行眼动校正的方法主要分为数据校正和硬件校正两种,前者已开发的后处理算法[5]对于大的眼动间隙无法进行纠正,校正效果不佳;基于硬件的校正系统主要有使用磁性搜索线圈来测量眼睛前段的运动[6],使用来自前光学系统的反射运动[7],这类硬件系统都是对眼前节部分进行运动监测,无法直接获得眼底视网膜的运动情况,无法适用到OCTA成像系统的运动校正中。第一个基于视网膜图像的跟踪器使用简单的线扫描相机测量血管的横向运动[8]。SLO(Scanning Laser Ophthalmoscopy)的共焦性允许捕获高质量的视网膜正面视频,SLO在眼动追踪方面的优势很早就得到了认可,为本文提出的眼动跟踪校正奠定了基础。
为了提高OCTA成像的准确性和稳定性,本文提出了一个基于硬件的主动眼底跟踪SLO光学系统集成到OCTA系统的方法,旨在实现实时的眼动矫正,从而消除由于外界环境或被测者的自然行为等因素对OCTA成像结果准确性的潜在影响。本文中所提出的方法还采用了多种关键技术。首先,采用了Frangi滤波和四象限角点匹配的方法进行偏移计算,以准确测量眼动引起的图像偏移。其次,通过引入GPU并行处理的编程方法,实现了快速而高效的眼动矫正,从而提高了系统的实时性和性能。这一研究的结果不仅有望提高OCTA成像的准确性和可靠性,还可能在眼科临床诊断、研究和治疗中发挥重要作用。通过有效地消除眼动引起的伪影,该系统有望为眼科专业人员提供更清晰、更精确的眼底成像,有助于更准确地诊断和监测眼部疾病,为患者提供更好的视力健康护理。
1" 装置系统
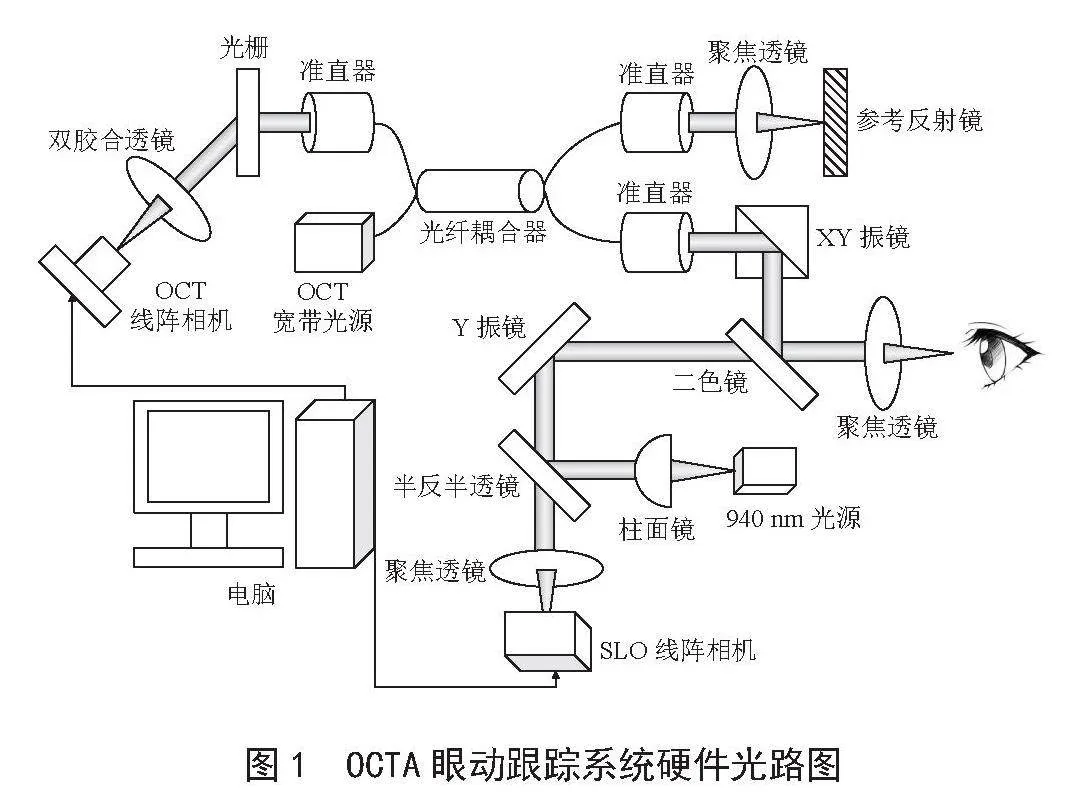
OCTA的成像系统主要基于迈克尔逊干涉仪成像原理搭建[9]。迈克尔逊干涉仪的原理是一束入射光经过分光镜分为两束后各自被对应的平面镜反射回来,因为这两束光频率相同、振动方向相同且相位差恒定(即满足干涉条件),所以能够发生干涉。通过调节干涉臂长度或改变介质的折射率会形成不同的干涉图样。干涉条纹是等光程差的轨迹,因此通过分析干涉产生的图样可以获得各段光程的信息,即对应样品不同深度的信息。眼动跟踪SLO成像技术[10]基于红外光具有较强的组织穿透能力、对人眼是不可见的特性,红外激光发出红外光束透过眼球前部结构照射到患者眼底,眼底组织会吸收、反射和散射这些红外光,此时使用一个专门的相机捕获从眼底反射回来的红外光,将其转换为数字图像,电脑再获取数字图像进行显示就可以实时对患者眼底进行成像。
硬件系统主要分为两个部分:OCTA成像系统和眼动跟踪SLO系统,具体如图1所示。
图1" OCTA眼动跟踪系统硬件光路图
OCTA成像系统采用中心波长840 nm的宽带光源,经过70:30光纤耦合器将激光分流到含参考反射镜的参考臂一路和扫描眼底的样品臂一路,加入二维XY扫描振镜可以改变扫描样品的光束方向,实现对眼睛的三维成像。二色镜可将OCT光反射到眼睛,OCTA光路的激光经眼底和参考反射镜的反射沿来路返回光纤耦合器,相遇并干涉,干涉光经过光栅,将干涉信号从位置空间转变为波矢空间,被OCT线阵相机接收,转换为数字信号到电脑进行处理从而获得眼底血流信息。
SLO跟踪系统采用940 nm激光光源,该波长的光源具有较强的组织穿透能力、对人眼是不可见,眼底成像效果更好且不会在OCTA采集过程中影响到人的注意力,不会造成多余的眼动干扰。激光光源经过柱面镜变成线状光,经反射镜反射到Y振镜,线状光搭配Y振镜的偏转可实现对眼底的二维成像。引入反840 nm光透940 nm光的二色镜可以将SLO系统的光路引入OCTA成像系统中,两个光路共用眼前透镜达到对眼底共焦的效果。激光被眼底组织反射,沿来路回到半反半透镜,部分光线透过半反半透镜,经过聚焦透镜被SLO线阵相机接收,转换为数字信号到电脑进行处理获得眼底二维图像。
2" 图像处理方法
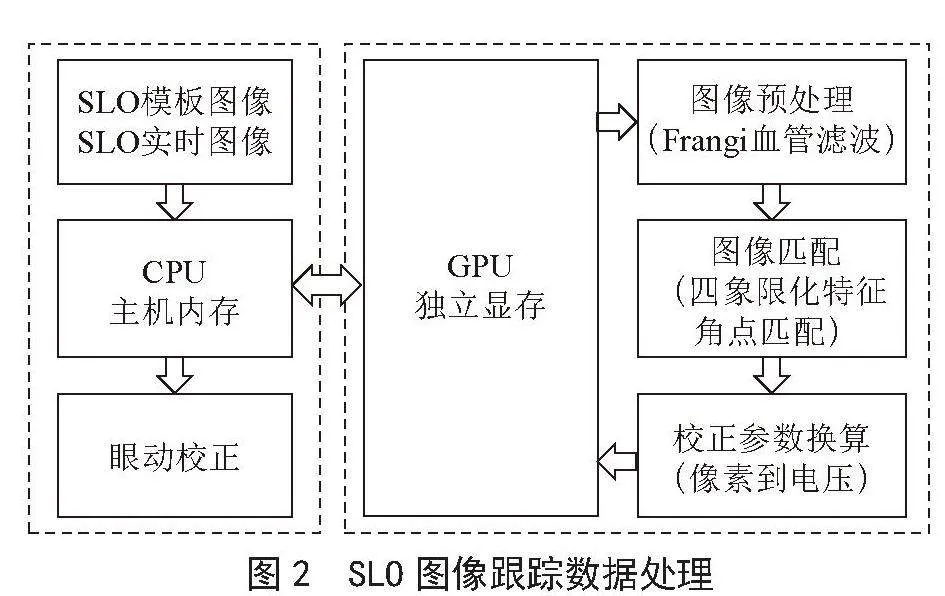
本文的图像处理快速计算主要调用图形处理器(Graphic Processing Unit, GPU)作为数据并行处理的设备,与中央处理器(Central Processing Unit, CPU)处理程序顺序部分相互协作,可以弥补CPU在处理大规模数据上的不足,提高程序的运行性能[11]。SLO图像跟踪数据处理如图2所示,其中粗黑箭头代表数据在主机端和设备端之间的数据拷贝方向,细白箭头代表数据分别在主机端、设备端的内部处理步骤。按照CPU-GPU混合硬件结构编程的方式,将SLO图像跟踪的处理过程所需的内存空间在CPU和GPU上进行分配,图像预处理的滤波部分,四象限化特征角点匹配的图像匹配部分均可进行并行处理,根据算法原理改为适合的并行函数,在GPU上运行,达到快速实时计算SLO图像偏移量的效果。
图2" SLO图像跟踪数据处理
图像预处理部分,由于SLO眼底图像中存在血管纹路不清晰、血管走向模糊的情况,需要先使用血管增强算法,提高SLO眼底图中的血管信息。本文采用Frangi血管滤波是匹配滤波器的一种延伸,由于SLO眼底图像上的血管信息具有高斯分布的特性,所以将高斯型滤波器与血管进行匹配,若二者匹配则输出一个较大的值[12,13]。
Hessian矩阵表达式为:
(1)
其中,fxx、fxy、fyx、fyy分别表示像素P的灰度的四个二阶偏导数。H具有两个特征值,其中较大的特征值λ1,能够很好的描述视网膜图像的血管信息。Frangi等人利用Hessian矩阵特征值构造血管相似性函数:
(2)
式中,RB = λ1 / λ2 ,,则表示矩阵的范数。c表示矩阵最大范数的一半。该算法求出的尺度因子具有特异性,不能适用于不同直径大小的血管。为了使SLO眼底图像上不同直径大小的血管在控制引入新噪声同时得到达到较好的增强效果,最后将滤波器的响应整合不同尺度下:
(3)
其中δmin表示相关结构最小尺度、δmax表示相关结构最大尺度,可以通过设置它们的值调整滤波核的宽度。
经过Frangi滤波处理后的获取的血管图像如图3所示。本来包含组织信息和血流信息的SLO眼底图像经过滤波处理后保留下了血管信息,组织部分的像素全部置为0。
图3" Frangi算法增强后的眼底血管图
四象限化角点匹配首先在模板图像和实时图像上进行上下左右靠近边界的地方选取四个方形大小的窗口数据提取。通过四象限化提取窗口数据进行匹配计算的方法可以减少运算量,也可以细化区域提高匹配计算的准确性。
角点检测是图像特征提取的一种有效方法[14]。角点检测中的角点指的是两个方向的边界的交点,因为是两个不同方向的交点,所以该点在任意方向的变化都会使该点附近的梯度图产生显著的变化。本文使用的shi-Tomasi角点检测算法对图像进行角点匹配,该算法是Harris算法的延伸。Shi和Tomasi对Harris的算法中的阈值选取方式提出改进,若两个特征值中较小的一个大于最小阈值,则会得到强角点[15]。Harris矩阵M表示为:
(4)
Shi和Tomasi提出的公式为:
(5)
具体算法步骤如下:首先,分别利用水平和垂直的差分算子对图像进行滤波来求得Ix、Iy,根据(4)式求出矩阵M;第二,求出M行列式的两个特征值λ1和λ2,根据Shi-Tomasi提出的判定方法,判断该像素点是否为强角点;然后,为了平衡匹配点的数目和防止匹配区域发生重叠,设定两个阈值分别约束特征点的数目和相邻特征点的距离;最后,进行主模板角点和实时角点之间的迭代计算偏移量,作为实时SLO图像的偏移量。
3" 系统工作流程
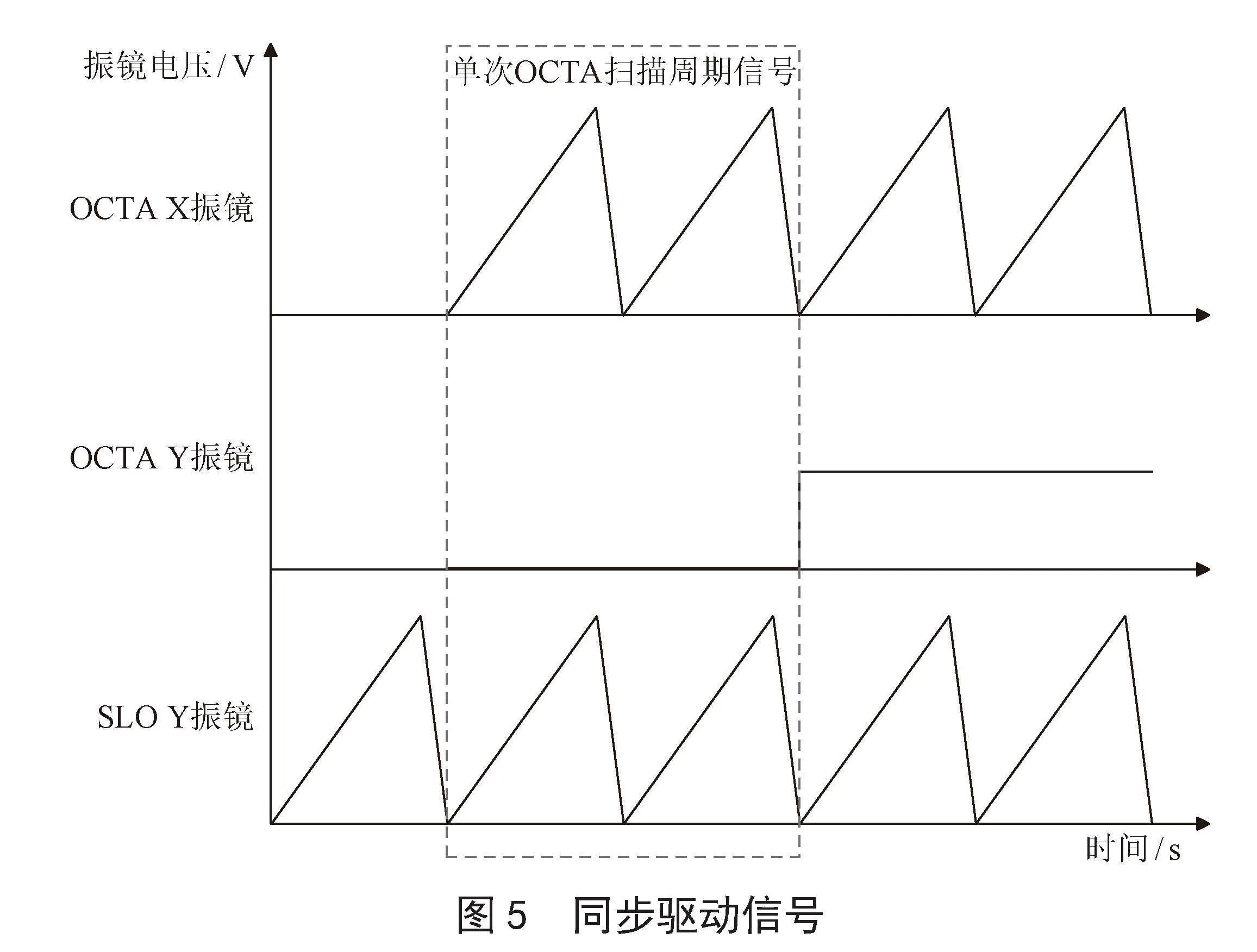
眼动跟踪系统工作步骤如图4所示。当OCTA开始采集时,SLO眼动跟踪系统也会同时开始工作。
由于OCTA系统和SLO跟踪系统都是采用振镜偏转完成红外光对眼底的扫射成像,为了能够达到快速跟踪的效果,需要设计两组振镜对眼底的同时扫描。图5为开始时OCTA和SLO跟踪的同步驱动信号。振镜的工作机制是输入一个位置信号即图5纵轴的振镜电压,摆动电机就会按照一定电压与角度的转换比例摆动一定角度。单次的OCTA断层扫描周期信号如虚线框部分所示,需要进行两次OCTAX振镜的重复扫描,此时OCTAY振镜停在同一偏转角度,即对眼底的同一位置进行两次断层扫描。从图中可看出在OCTA开始扫描前SLOY振镜先进行一次扫描偏转,目的是提前采集一张SLO眼底图像作为模板,用于与后续SLOY振镜与OCTAX振镜同步扫描获取的实时SLO眼底图像进行匹配,计算偏移,快速完成跟踪校正。
图5" 同步驱动信号
4" 系统测试结果
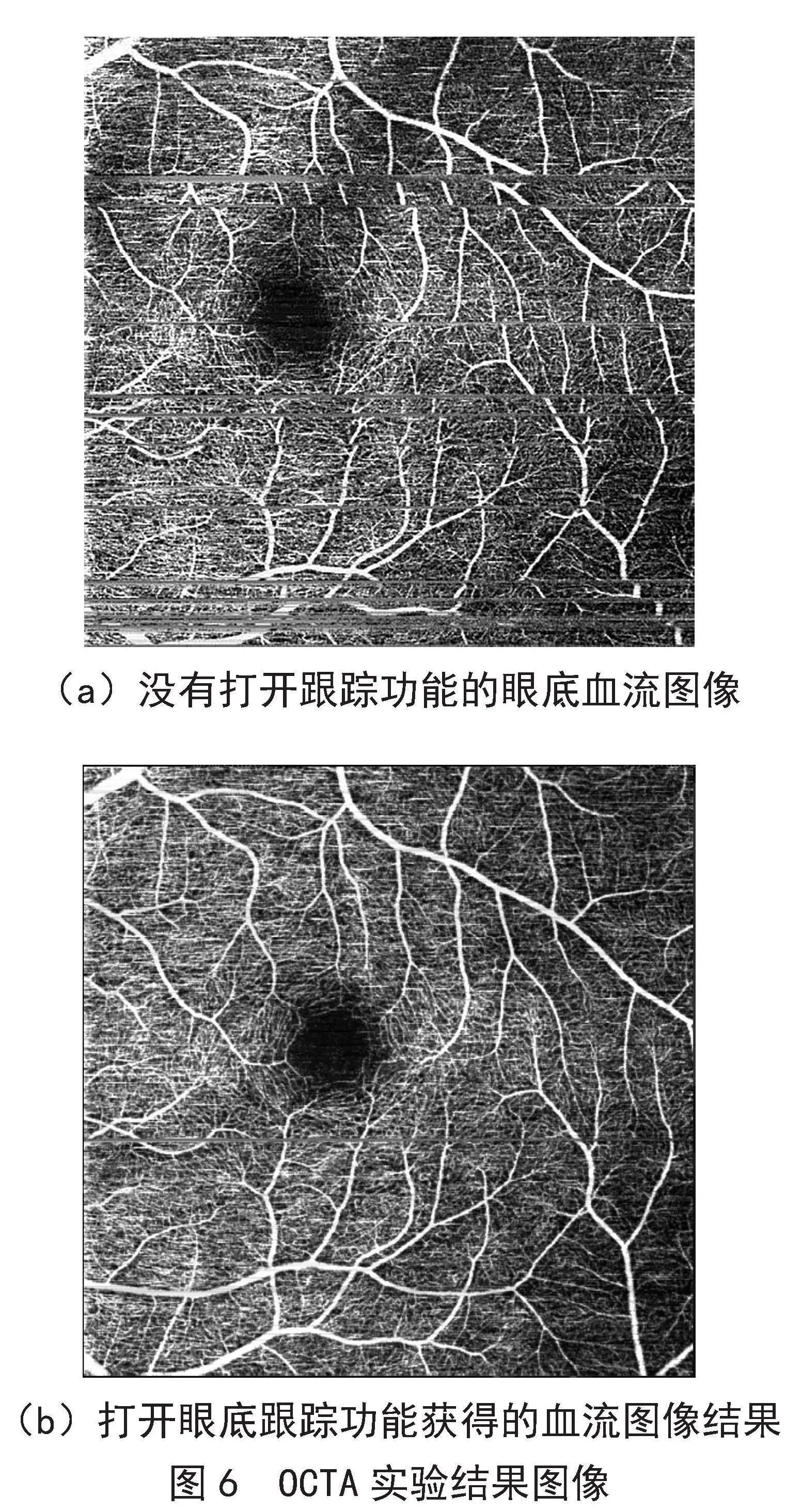
通过实验室内验证该系统原理,充分证明了该系统的可靠性。以下图像结果是将眼底跟踪系统集成到OCTA系统中获得的眼底血流图像,如图6所示。没有使用眼动跟踪功能的OCTA系统扫6 m×6 m范围所得到的眼底血流投影图像,如图6(a)所示,使用了眼动跟踪功能的OCTA系统扫6 m×6 m范围所得到的眼底血流投影图像,如图6(b)所示。
(a)没有打开跟踪功能的眼底血流图像
(b)打开眼底跟踪功能获得的血流图像结果
图6" OCTA实验结果图像
对比两种结果,我们可以明显观察到右侧使用了眼动跟踪功能的图像与左侧图像相比在多个方面都表现出了显著的改善。首先,右侧图像中的血管呈现出更为连续和通畅的特征。这一改进是由于眼动跟踪系统的实时监测和调整,以确保光束在成像过程中与感兴趣的血管结构保持对准。相比之下,左侧图像中的血管显示出不连续和不规则的特征,这可能是由于眼动引起的图像偏移导致的。其次,右侧图像使我们能够更清晰地分辨出毛细血管和大血管之间的区别。这种分辨率的提高对于定位潜在的病变位置和进行精确的诊断非常关键。在左侧图像中,由于眼动引起的图像模糊和伪影,血管结构的细节可能会失真或模糊不清,这可能会导致医生在诊断过程中遇到困难。相对而言,右侧图像的改善有助于医生更准确地进行诊断和治疗决策。眼动跟踪功能提供了更高质量的成像数据,使医生能够更全面地了解患者的眼部情况,从而更好地选择治疗方案和监测疾病进展。
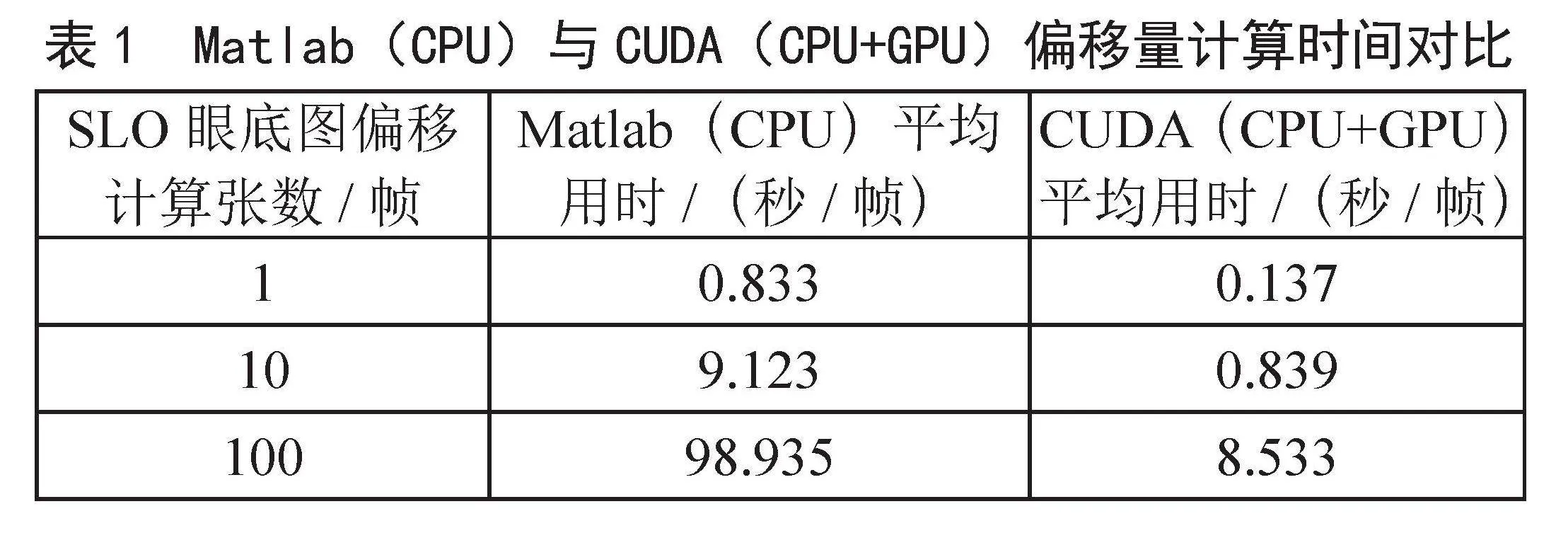
同时为了验证跟踪算法的快速程度,实验过程中分别使用了基于CPU运算的Matlab平台和基于CPU+GPU结合使用的CUDA(Compute Unified Device Architecture)平台对SLO眼底图像跟踪匹配算法进行了编程和用时对比,时间对比结果如表1所示。
表1" Matlab(CPU)与CUDA(CPU+GPU)偏移量计算时间对比
SLO眼底图偏移计算张数/帧 Matlab(CPU)平均用时/(秒/帧) CUDA(CPU+GPU)平均用时/(秒/帧)
1 0.833 0.137
10 9.123 0.839
100 98.935 8.533
从表1中得出,使用CPU+GPU的编程模式对计算SLO眼底图像偏移更快速,以单次的偏移计算为例,CPU+GPU的计算时间更短,更符合在OCTA采集过程中快速偏移校正的要求,且随着SLO眼底图数据集的增加,CPU+GPU模式的计算效率明显提高,也更加凸显了并行计算的优势,对于OCTA眼动跟踪过程中持续采集SLO眼底图像进行偏移计算的要求也能轻松完成,提高了OCTA的数据采集效率。
5" 结" 论
在进行OCTA成像时,将眼底跟踪SLO成像系统集成到OCTA系统的方法对于提高成像质量和临床应用的准确性至关重要。通过实时监测和校正患者的眼球运动,眼动跟踪系统显著改善优化了OCTA成像系统的多个方面。第一、在开始采集前起到辅助眼底定位作用。因为SLO系统和OCTA系统公用眼前的透镜,两者可以达到共用一个焦点的效果,所以只要在调试过程中观察SLO眼底图像的聚焦清晰程度就可以基本确定眼底视网膜位置,从而迅速确定OCTA扫描位置获得断层图像;第二、提高了OCTA的成像质量。从上文可知OCTA数据和SLO眼底图像都是同时连续获取的,本文引用的GPU并行计算处理方法可以快速计算出相邻时间SLO眼底图像的偏移量,根据偏移量换算到OCTA系统中的振镜进行校正补偿和数据重采完成对感兴趣部分的扫描,使OCTA图像中的血管呈现更为连续和通畅,提高了分辨率,更方便医生观察血管的分布和形态,对于诊断和定位病变位置起到辅助作用,进一步地改进了医生的诊断和治疗决策的依据,从而更好地选择适当的治疗方案和监测疾病的进展。
综上所述,眼动跟踪系统的引入为OCTA成像提供了更高水平的准确性和可靠性。它通过实时消除外界环境和自然眼动对成像的干扰,提供了更清晰、更高分辨率的眼底图像,为眼科临床实践和疾病诊断提供了重要的支持。这一技术的应用有望改善视力健康护理,为眼科领域的进步作出贡献。
参考文献:
[1] 王敏,周瑶.正确认识OCT血管成像技术的临床应用价值 [J].中华实验眼科杂志,2016,34(12):1057-1060.
[2] SPAIDE R F,FUJIMOTO J G,WAHEED N K,et al. Optical coherence tomography angiography [J]. Progress in retinal and eye research,2018,64:1-55.
[3] GAO S S,YALI J,LIANG L,et al. Compensation for Reflectance Variation in Vessel Density Quantification by Optical Coherence Tomography Angiography [J].Investigative Ophthalmology amp; Visual Science,2016,57(10):4485-4492.
[4] KLEIN T,WIESER W,EIGENWILLIG C M,et al. Megahertz OCT for ultrawide-field retinal imaging with a 1050 nm Fourier domain mode-locked laser [J].Optics Express,2011,19(4):3044-3062.
[5] KRAUS M F,POTSAID B,MAYER M A,et al. Motion correction in optical coherence tomography volumes on a per A-scan basis using orthogonal scan patterns [J].Biomedical Optics Express,2012,3(6):1182-1199.
[6] ROBINSON D A.A Method of Measuring Eye Movement Using a Scleral Search Coil in a Magnetic Field [J].IEEE Transactions on Biomedical Engineering,1963,10:137-145.
[7] CRANE H D , STEELE C M .Accurate three dimensional eye tracker:US06/206489[P].US04373787A.
[8] CORNSWEET T N. New Technique for the Measurement of Small Eye Movements [J]. J. Opt. Soc. Am.,1958,48:808-811.
[9] FERCHER A F. Optical coherence tomography [J].Journal of Biomedical Optics,1996,1(2):157-73.
[10] YAZAWA K,KOBAYASHI K,MATSUMOTO K,et al. Ophthalmologic apparatus having an examining system for examining the fundus of an eye:US08/023114 [P]. US05455644A,2023-09-22.
[11] 方旭东.面向大规模科学计算的CPU-GPU异构并行技术研究 [D].长沙:国防科学技术大学,2017.
[12] FRANGI A F,NIESSEN W J,VINCKEN K L,et al. Multiscale vessel enhancement filtering [C]//International Conference on Medical Image Computing and Computer-assisted Intervention.Berlin:Springer,1998:130-137.
[13] 张梦达.改进 Hessian 增强的自适应阈值水平集肝脏血管分割方法研究 [D].秦皇岛:燕山大学,2019.
[14] 章为川,孔祥楠,宋文.图像的角点检测研究综述 [J].电子学报,2015,43(11):2315-2321.
[15] WU S,OERLEMANS A,BAKKER E M,et al. A comprehensive evaluation of local detectors and descriptors [J].Signal Processing:Image Communication,2017,59:150-167.
作者简介:岑颖珊(1999—),女,汉族,广东佛山人,硕士研究生在读,研究方向:光电信息工程;通讯作者:韩定安(1976—),女,汉族,湖南湘潭人,教授,博士,研究方向:物理光学。

