
摘" 要:利用电化学活性生物膜测定水质生物毒性,具有灵敏度高、响应速度快、不受水体色度浊度干扰的优点。目前,商业化水质生物毒性监测装备已实现了在线监测,但MES中菌种易老化、遭遇水质毒性冲击后难以快速恢复,需要人员前往现场维修甚至更换,不仅成本高昂而且极易传感器未恢复而缺失测试数据,无法满足长期在线监测需求。因此,开展了基于自动在线修复式生物膜的水质生物毒性传感器的研制,从MES构型设计、MES启动、MES在线自动修复方案四个方面阐述了设计要点;并将搭建的两台样机应用于地表水自动在线监测站,稳定运行6个多月;运行数据表明了该方案的可行性。
关键词:电化学活性生物膜;水质生物毒性;自动修复;微生物电化学传感器
中图分类号:TP212.9" 文献标识码:A" 文章编号:2096-4706(2024)24-0153-05
Research and Application of Water Quality Biological Toxicity Sensor Based on Automatic Online Repair Biofilm
GE Yanhong, ZHA Fan, FU Qiong, YU Mei, HUANG Zhiyi, MAO Zhipeng, HU Yifan
(Guangdong Infore Technology Co., Ltd., Foshan" 528322, China)
Abstract: The use of electrochemically active biofilms to determine biological toxicity of water quality has the advantages of high sensitivity, fast response speed, and no interference from water color and turbidity. At present, commercial biological toxicity of water quality monitoring equipment has achieved online monitoring, but the strains in MES are prone to aging and difficult to quickly recover after encountering water quality toxicity impacts, which need personnel to go to the site for maintenance or even replacement. It not only incurs high costs but also makes it easy for sensors to not recover and lose test data, which cannot meet long-term online monitoring needs. Therefore, the development of biological toxicity of water quality sensor based on automatic online repair biofilm is carried out, and the design points are elaborated from four aspects of MES configuration design, MES startup, and MES online automatic repair scheme. And the two built prototypes have been applied to the automatic online monitoring station for surface water, running stably for more than 6 months. The operational data indicates the feasibility of the scheme.
Keywords: electrochemically active biofilm; biological toxicity of water quality; automatic repair; microbial electrochemical sensor
0" 引" 言
习近平总书记曾多次强调绿水青山就是金山银山,水安全是治国安邦的头等大事。研制具有我国自主知识产权的水质综合毒性检测技术及装备,对于保障人民用水安全、促进经济社会发展、建设美丽中国具有重要意义[1]。同时,随着环境监测行业智能化、自动化需求不断提升,环境监测设备也从实验室人工测试设备向现场自动化无人值守方向发展,如何保持现场长期在线自动运行过程设备的稳定性、降低人工维护成本也成为目前环境监测行业研究热点[2]。自动化在线监测仪器是实现我国“水质监测天网”的关键[3]。
水质毒性检测技术分为理化分析技术、生物监测技术。理化分析技术是基于物理或化学分析方法,通过定量常见水体污染物而判断水质毒性,对常见毒性污染物灵敏度极高,但无法检测水体中可能存在新型毒性污染物,检测过程实验体系复杂、操作流程烦琐,难以实现水质毒性实时监测。同时,由于毒性污染物间具有复杂毒理学效应,理化分析技术仅能反映水体中毒性污染物含量,无法真实反映水质的综合毒性。因此,理化分析技术难以满足水质综合毒性实时监测、环境预报预警的需要。生物监测技术是基于生物与环境相适应的原理,水体中出现有毒污染物时会抑制生物的代谢活性,通过测量生物的代谢水平完成水质毒性检测。生物监测技术已报道的受试生物包括鱼类、藻类、蚤类、蚌类和发光细菌等。但是这些方法存在灵敏度低、测试结果易受水体工况干扰、操作复杂、成本高等缺点[4-9]。例如目前较常见的受试生物发光细菌,可通过测量水体对发光细菌所产生荧光抑制程度,评价水质的综合毒性。但高性能光电转换元件昂贵,监测成本大幅度地增加;所测量的光信号不仅受发光细菌代谢水平影响,还受到水体色度、浊度有关,检测结果极易出现“假阳性”。因此,生物监测技术目前也不能完全满足水质综合毒性实时监测、环境预报预警需要。
以电化学活性微生物(EAB)生物膜为核心的微生物电化学传感器(MEB),可直接将水体中待测物质转导为生物电信号,具有检测迅速、灵敏度高、检测成本低、抗干扰能力强等优势,在环境监测领域具有良好的应用前景[10-14]。目前,我国和国际上均成功研制了不受水体色度、浊度影响的水质生物毒性监测装备,例如韩国KORBI公司的HATOX2000,中外合资雪迪龙公司的Model-9880以及我国盈峰公司的YF-TOX。这些装备中,均使用了电化学活性菌(Electrochemically Active Bacteria, EAB)代替发光细菌测定水质生物毒性。EAB是具有独特能量代谢方式的细菌,能够将呼吸作用产生的电子传递至胞外。在正常生理状态下,EAB能够产生稳定的生物电信号[15-16]。当暴露于有毒水体时,EAB代谢活性降低、电信号下降,因此检测EAB的电信号即可判断水质生物毒性,而电信号不受水体色度浊度的影响[17]。微生物电化学传感器(Microbiol Electrochemical Sensor, MES)以其特有的电化学活性生物膜可自动富集、自动更新的特点[18],为水质生物毒性长期在线自动监测提供了可能,但目前市场应用的MES常常因传感器电极生物膜不断加厚、老化,以及内部微生物、杂质吸附在传感器内表面等原因,导致在现场运行一段时间后,出现传感器信号不稳定、对毒性物质响应灵敏度减弱等问题[19-20]。目前,主要通过人工到现场对传感器进行手工清洗或者直接更换新传感器的方式应对以上问题。然而手工清洗难度极高,极易因操作问题导致传感器中微生物失活或者死亡,而更换新传感器又给长期运行增加了大量成本。
据此,面向突发水污染事件早期预警和水质生物毒性长期在线自动监测的重大需求,本团队开展了基于生物膜自动在线修复功能的水质生物毒性传感器的研制,并将其应用于地表水自动在线监测站,稳定运行时间超过6个月,验证了该方案可行性。
1" 水质生物毒性MES构型设计
如图1所示的内容为水质生物毒性MES构型,图1(a)为实物图,(b)为三维设计图。主体由下方基座与上方盖体组成,基座与盖体之间用4只螺钉连接固定,其间放密封圈保证密封不漏水;基座与盖体内部均为“柱形+锥形”凹槽,二者共同组成MES的内腔,微生物电化学反应在此内腔中进行;包含工作电极、对电极、参比电极3个电极,顶部为Ag/AgCl参比电极,右边上下分别为对电极、工作电极,对电极头部固定1 cm×1 cm铂片,工作电极头部固定同等大小碳纸、碳毡等导电材料,EAB可附着其上完成微生物电化学反应;左侧有进液口,顶部有1出液口,日常测试溶液从此处进出MES内腔;另外,底部还有一处清洗通道,日常测试时该通道处于关闭状态,MES修复过程中该通道可自动打开/闭合。
2" 水质生物毒性MES启动
接种培养。首先,配制新鲜培养液,每升新鲜培养液含NaCl 5.0 g、NH4Cl 3.8 g、KCl 0.3 g、NaH2PO4 1.5 g、Na2HPO4 5.8 g、NaAc 0.8 g,调节pH酸碱度至6.8~7.2之间,置于恒温培养箱22.5±0.5 ℃中,使用前以500 mL/min速率通入纯度>99.5%的氮气10 min。第二,将新鲜培养液与种源出水(含地杆菌、喉杆菌、假单胞菌、希瓦氏菌、固氮螺菌和不动杆菌中的至少一种EAB)以1:1混合,得到接种菌悬液。第三,按图1组装MES若干,从MES进水口加入接种菌悬液,装满MES内腔,连接恒电位仪,设置恒电位仪培养电压为0 V,启动恒电位仪培养,实时监控各通道培养过程电流。
换液流程。启动培养后,新培养体系各通道培养电流会先逐渐升高,随着营养消耗,后期会逐渐降低,当降到最低点(10-8 A)稳定后从进水口缓慢打入20 mL新鲜培养液,从出水口置换出20 mL原体系培养液。之后每次换液,电流达到峰值后降低到10-8 A后就更换一次,如此反复操作4~6次,当后一次换液第20 min到第40 min的电流增长速度小于0.005 mA/s则认为MES启动完成(或者出现相邻两次换液流程的培养电流峰值大小偏差不差过±10%时,也可认为MES启动完成)。
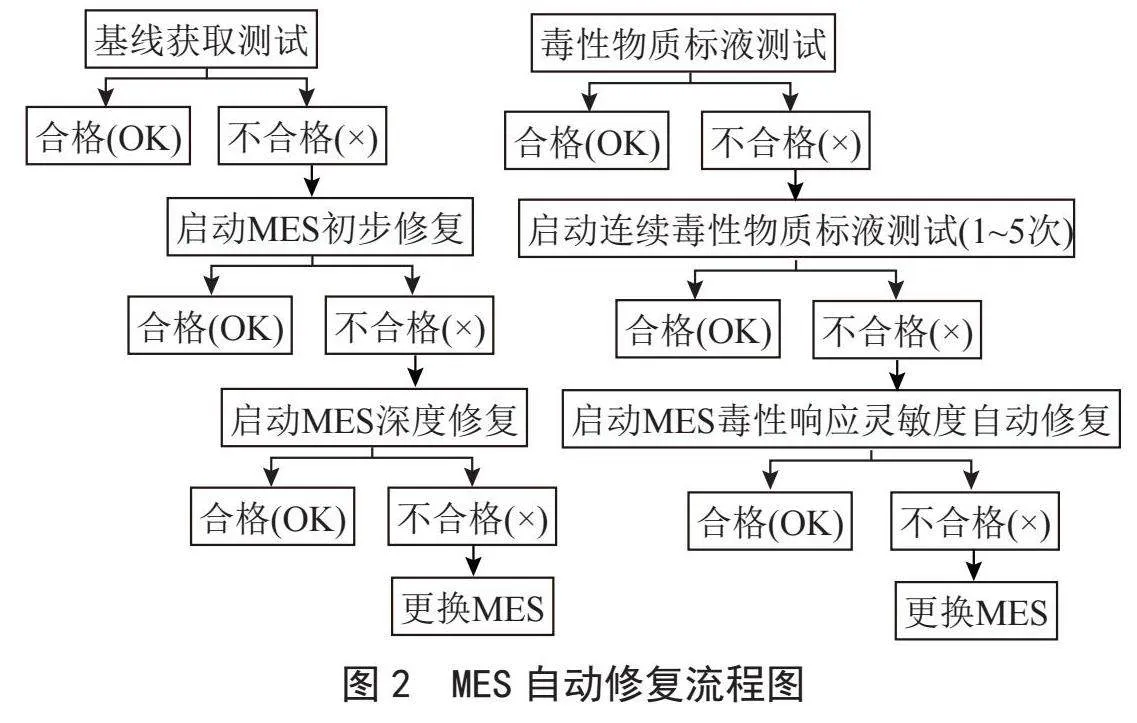
3" 水质生物毒性MES自动修复方案
在长期运行过程中,MES中会滋生各种杂菌,这些杂菌以及游离的EAB会附着在传感器内壁,一方面附着在内壁的微生物会消耗测试过程的营养液但无法输出测试信号,随着运行时间的延长,电极上的EAB会因长期的营养逐渐降低而输出的电信号逐渐减小最终导致无法测试;另一方面,这些附着在内壁的微生物可能对水样中某些有毒物质(如重金属、有机毒性物质等)进行吸附,导致游离在反应体系中的有毒物质浓度降低,从而电极上的电化学活性微生物难以响应,最终导致水质生物毒性在线监测仪对水体中有毒污染物响应能力降低失去毒性预警作用。因此,如果降低传感器内壁上微生物的附着对测试的影响至关重要。另外,随着运行时间的延长,电极上的EAB不断繁殖,新生的EAB不断的一层又一层得覆盖在电极上,最终形成巨大的“老化菌体-菌体分泌物-新生菌体-水中悬浮物-水中有毒物质等”“有机团”。一方面,监测过程中反应体系中的有毒物质很难渗入“有机团”内部参与反应;另一方面,当“有机团”老化到一定阶段后,内层直接附着电极的微生物全部老化后,有机团会部分或者整体直接从电极脱落,导致传感器信号发生突变,有时会脱落一部分悬浮于电极周围,测试过程中,在流动的测试溶液中悬浮于电极周围的“有机团”会时而与电极接触(产生的电信号可以输出)时而不与电极接触(产生的电信号不能输出),导致测试信号异常变化。因此,解决老化“有机团”也是水质生物毒性在线监测仪在线长期运行的关键。
3.1" MES初步修复
在长期运行过程中,设备发生故障、缺少试剂、现场停水等问题导致设备中断运行,MES中菌种缺少营养物质从而信号降低,或者测试的水样中存在有毒物质导致MES中EAB中毒从而信号降低,可以通过启动MES初步修复流程,让传MES从异常状态中逐步恢复。
3.2" MES深度修复
当MES经过多个初步修复过程后,输出信号仍未能达标时,考虑可能是传感器中生物电极老化、内壁附着过多杂菌等原因,需进行深度修复。深度修复主要是通过采用高速循环水流冲击传感器内壁以及生物电极,达到剥离附着过厚的生物膜的目的,同时调高生物电极电势,增强游离的目标EAB重新吸附到生物电极上。修复后的传感器,内壁上吸附的杂菌被冲刷下来之后被水流带走,电极上老化的EAB脱落后也被水流带走,而溶液中游离的高活性的目标EAB则被调高电势的电极重新选择性吸附,最终形成新的生物膜。
3.3" MES毒性响应灵敏度修复
当连续几次质控测试结果不合格时,可能是MES发生老化,内壁上附着的微生物吸附了反应体系中的毒性物质导致反应体系中接触到生物电极的毒性物质浓度降低,或者是生物电极形成过后的生物层、反应体系中毒性物质难以接触到内层微生物导致作用效果降低,此种情况下可通过先注入含高浓度毒性物质的传感器电解液,使传感器中大部分微生物在毒性胁迫中失去活性,从而降低了其对传感器内壁、电极的吸附力而迅速脱落,沉降于MES底部,然后被水流抽出。同时,在毒性逆境胁迫下,调高生物电极电势,高活性的EAB会自动选择再次吸附于生物电极,最后通入高浓度有机底物的无毒电解液进一步促进电极上目标EAB繁殖,从而实现MES自动更新修复,流程如图2所示。
4" 水质生物毒性MES在实际水体毒性监测中的应用
4.1" 测试方法
在广东省佛山市选取两处重点饮用水水源地水质自动监测站(分别记为监测站1、监测站2),各安装一台微生物电化学法水质生物毒性自动在线监测仪,启用MES在线自动修复功能,运行模式设置为自动运行,每天0点、4点、8点、12点、16点、20点测试实际水样,每天2点、14点自动完成MES校准,每天6点、10点、22点自动完成零点核查测试(测试空白水,检验MES基准信号波动范围是否合格),每天18点自动完成毒性物质标液测试(测试0.3 mg/L Cu2+,检验MES毒性响应灵敏度波动范围是否合格),按常规运行需求运行后,每天远程人工监控传感器信号,当发现数据异常时,先等待仪器执行自动修复功能,若仍未能恢复正常,人员前往现场进行处理。监测站1、2分别累计自动运行约7个月、6个月,分别统计设备运行率、数据有效率、零点核查测试合格率以及毒性物质标液测试合格率。
每天3次零点核查测试、1次毒性物质标液测试,全部结果必须满足零点核查测试MES电流抑制率IR0应在-5.00%≤IR0≤5.00%之间、毒性物质标液测试电流抑制率IR1应在30.00%≤IR1≤50.00%之间,否则当天水样测试结果无效。对实际水样测试电流抑制率IR≥30%的水样进行留样并筛查地表水108项指标,若无指标达到五类地表水限值的,判定该水样测试结果无效。设备运行率=100%×设备实际上传水样测试总次数/(运行总天数×6),数据有效率=100%×有效的水样测试结果次数/设备实际上传水样测试总次数,零点核查测试合格率=100%×满足要求的零点核查测试次数/零点核查测试总次数,毒性物质标液测试合格率=100%×满足要求的毒性物质标液测试次数/毒性物质标液测试总次数。
4.2" 结果分析
监测站1统计了2023年8月27日至2024年5月29日之间的运行数据,其中因采水故障、站房停电等不可抗力因素导致351次未进行水样测试,导致累计65天的停止运行,因此实际运行约7个月;监测站2统计了2023年8月21日至2024年4月21日之间的运行数据,其中因采水故障、站房停电等不可抗力因素导致**次未进行水样测试,导致累计56天的停止运行,因此实际运行约6个月。
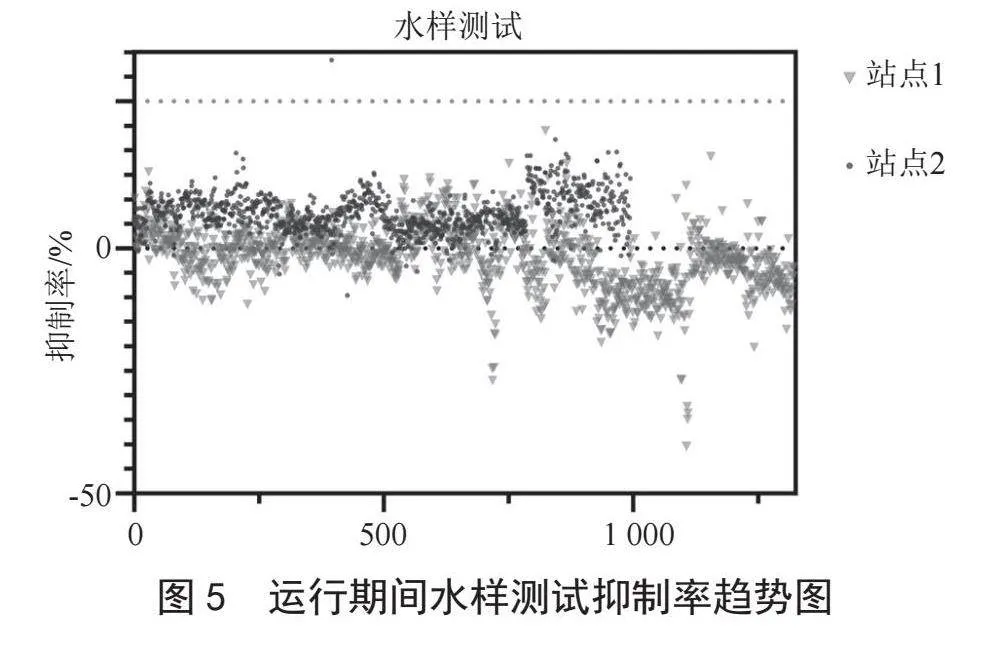
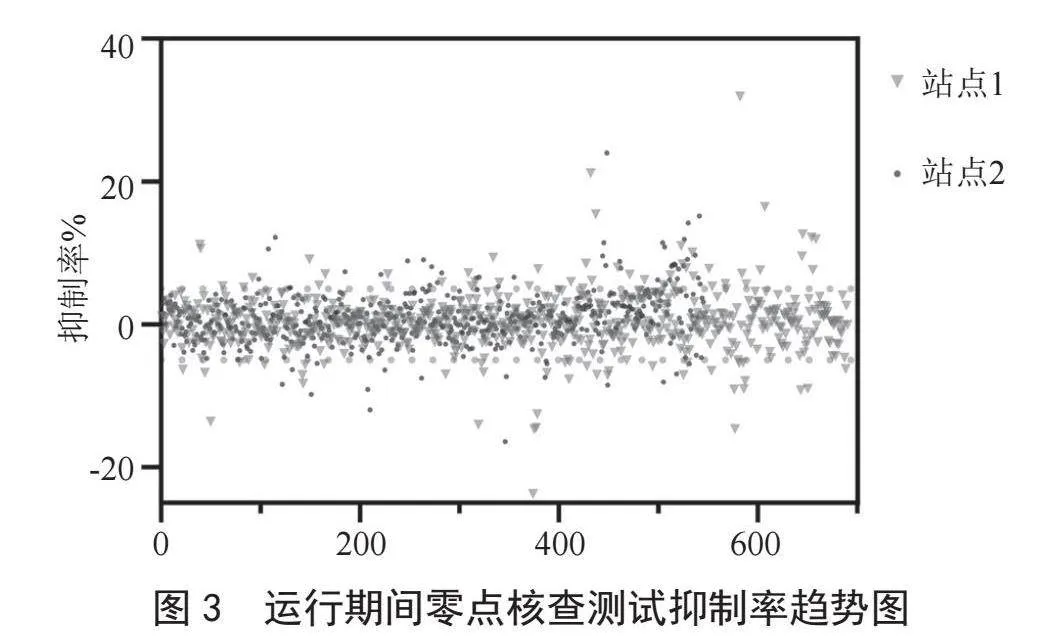
监测站1共开展零点核查测试690次,合格602次,不合格88次,测试合格率为87.24%,不合格主要原因为设备系统其他部分故障导致;监测站2共开展零点核查测试545次,合格480次,不合格65次,测试合格率为88.07%,不合格主要原因为设备系统其他部分故障及运维操作失误导致。如图3所示,其中展示了两处水质自动在线监测站生物毒性运行期间零点核查测试抑制率趋势,图中两条绿色线分别为抑制率5%、-5%,为零点核查测试合格限值,可看出大部分数据均在此区间,数据稳定。
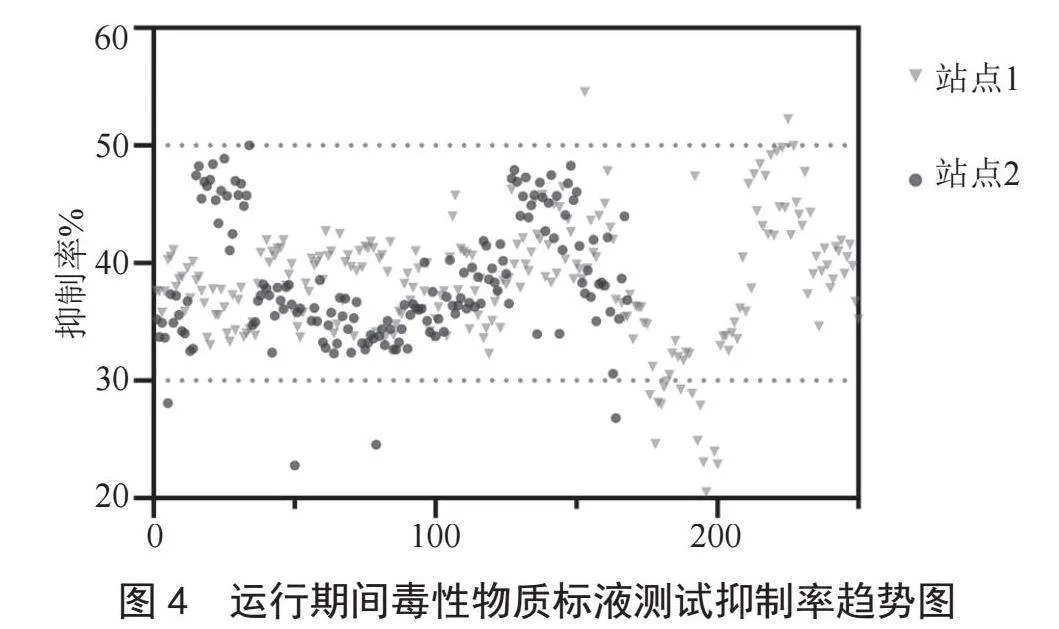
监测站1共开毒性物质标液测试250次,合格233次,不合格17次,测试合格率为93.20%,不合格主要原因为设备系统其他部分故障导致;监测站2共开毒性物质标液测试168次,合格157次,不合格11次,测试合格率为93.45%,不合格主要原因为设备系统其他部分故障及运维操作失误导致。如图4所示,其中展示了两处水质自动在线监测站生物毒性运行期间毒性物质标液抑制率趋势,图中两条黄色色线分别为抑制率30%、50%,为毒性物质标液测试合格限值,可看出大部分数据均在此区间,数据稳定。
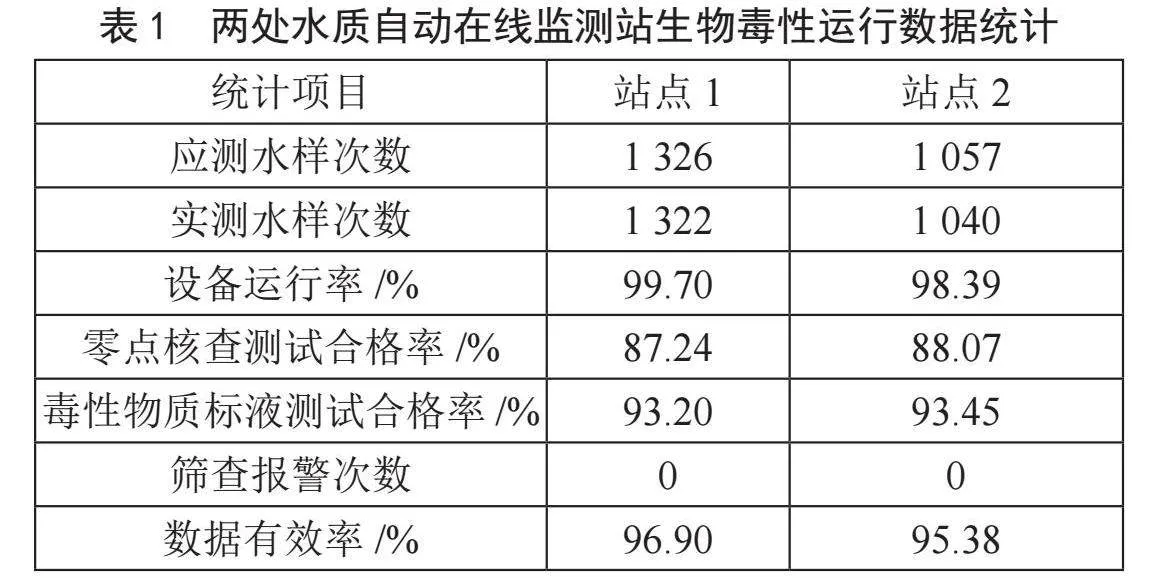
数据统计如表1所示,运行期间水样测试抑制率趋势图如图5所示。在统计的大半年运行过程中,设备运行率、数据有效率均超过95%,零点核查测试合格率均超过85%、毒性物质测试合格率超过90%,运行良好。
5" 结" 论
常规方法的水质生物毒性在线监测仪一般7~10天需运维人员前往现场维护,操作内容为更换菌种、清洗检测池、清洗检测管路等,人工维护量巨大,运行费用高。本方法采用可自动在线修复的生物传感器,在仪器运行过程中可根据生物基准信号、零点核查测试、毒性物质测试等运行信息自动启动传感器修复,大大降低了人工维护频次,实现平均每月人工维护约1次、约每4个月更换一次菌种,大幅度降低运行成本。表明可自动在线修复式传感器可以很好地应用于长期无人值守的水质自动在线监测中,不仅可以大大降低运行成本,也可以大幅度提高运行数据质量,可以为水环境污染监测、预警提供良好的技术支撑。
参考文献:
[1] 黄一兵.深入学习贯彻习近平生态文明思想 推动建设人与自然和谐共生的现代化 [J].环境与可持续发展,2023,48(1):11-13.
[2] 迟颖,张栩.2019年环境监测行业发展评述及展望 [J].中国环保产业,2020(3):19-22.
[3] 翟俊峰,余登斌,刘玲,等.基于媒介体的电化学水体总毒性检测方法现状及展望 [J].应用化学,2018,35(9):1102-1106.
[4] BEGHIN M,PARIS-PALACIOS S,MANDIKI S N M,et al. Integrative Multi-Biomarker Approach on Caged Rainbow Trout: A Biomonitoring Tool for Wastewater Treatment Plant Effluents Toxicity Assessment [J/OL].Science of The Total Environment,2022,838:155912(2022-05-25).https://doi.org/10.1016/j.scitotenv.2022.155912.
[5] 李震,廖伟,孙锋.鱼类行为法水质生物毒性监测仪性能测评研究 [J].计算机测量与控制,2021,29(3):248-251.
[6] LI L B,REN J T,CHEN J X,et al. Rapid and Versatile Colorimetric Sensor based on Luminescent Bacterium for Water Comprehensive Toxicity Detection [J/OL].Sensors and Actuators: B. Chemical,2023,390:133958(2023-09-01).https://doi.org/10.1016/j.snb.2023.133958.
[7] LI Y Y,ZHAO Y K,DU Y Y,et al.Recent Advances in the Development and Applications of Luminescent Bacteria-based Biosensors [J/OL].Luminescence,2024,39(3):4721.(2024-03-19).https://doi.org/10.1002/bio.4721.
[8] 戈燕红,闵文傲,刘宇,等.样品浊度对水质在线监测仪器参数检测的干扰影响研究 [J].自动化与仪器仪表,2023(11):71-76.
[9] 李歆琰,靳睿杰,饶凯锋,等.生物预警技术在水质自动监测中的应用研究 [J].农业与技术,2023,43(10):76-81.
[10] LOGAN B E. Exoelectrogenic Bacteria that Power Microbial Fuel Cells [J].Nature Reviews Microbiology,2009,7(5):375-381.
[11] LOGAN B E. Simultaneous Wastewater Treatment and Biological Electricity Generation [J].Water Science And Technology,2005,52(1-2):31-37.
[12] KIM B,CHANG I,GIL G,et al. Novel BOD (Biological Oxygen Demand)Sensor Using Mediator-less Microbial Fuel Cell [J].Biotechnology Letters,2003,25(7):541-545.
[13] KIM M,SIK H M,GADD G M,et al. A Novel Biomonitoring System Using Microbial Fuel Cells [J].Journal of Environmental Monitoring,2007,9(12):1323-1328.
[14] LEE J S,KIM D S,JEON H J,et al. Microbial Fuel Cell as a Biosensor to Monitor Various Toxic Metal Substances in Water [C]//2015 9th International Conference on Sensing Technology.Auckland:IEEE,2016:416-419.
[15] QI X,WANG S Y,LI T,et al. An Electroactive Biofilm-based Biosensor for Water Safety: Pollutants Detection and Early-Warning [J/OL].Biosensors and Bioelectronics,2021,173:112822(2021-02-01).https://doi.org/10.1016/j.bios.2020.112822.
[16] QI X,LIU P P,LIANG P,et al. Biofilms MorpHology Design for High Sensitivity of Bioelectrochemical Sensor: An Experimental and Modeling Study [J/OL].Science of The Total Environment,2020,729:138908(2020-08-10).https://doi.org/10.1016/j.scitotenv.2020.138908.
[17] 刘艳娟,卢洪斌,孟丽聪,等.微生物燃料电池型水质生物毒性传感器的研究进展 [J].中国给水排水,2023,39(16):1-7.
[18] PRÉVOTEAU A,RABAEY K. Electroactive Biofilms for Sensing:Reflections and Perspectives [J].ACS Sensors,2017,2(8):1072-1085.
[19] FLEMMING H C,WINGENDER J,SZEWZYK U,et al. Biofilms: An Emergent form of Bacterial Life [J].Nature Reviews Microbiology,2016,14(9):563-575.
[20] RAGO L,CRISTIANI P,VILLA F,et al. Influences of Dissolved Oxygen Concentration on Biocathodic Microbial Communities in Microbial Fuel Cells [J].Bioelectrochemistry,2017,116:39-51.
作者简介:戈燕红(1979—),女,汉族,江西吉安人,高级工程师,博士在读,研究方向:精密仪器研发与管理。


