
摘 要:【目的】挖掘和获得原驼乳中的乳酸菌资源。
【方法】采集新疆乌鲁木齐县近效南山周边原驼乳样品,采用平板稀释法分离菌株,观察比对16S rRNA基因序列测序和菌株形态学特性,分析菌株分类学地位,并检测菌株溶血性和有害代谢物质等食用安全性。
【结果】获得29株乳酸菌,经鉴定其归属于Leuconostoc、Lentilactobacillus两个属的4个种;菌株均可耐受0.5%胆盐,5%NaCl,且具有较好耐高温、牛奶胨化、抗氧化和抑制细菌等特性;所有菌株均无溶血现象,不产生硝基还原酶;除T12外,均利用氨基酸不产生物胺。
【结论】从原驼乳中获得的乳酸菌具有良好的发酵特性和食品安全性。
关键词:原驼乳;乳酸菌;分离筛选
中图分类号:S188 文献标志码:A 文章编号:1001-4330(2024)04-1021-08
0 引 言
【研究意义】乳酸菌(Lactic acid bacteria, LAB) 是利用可发酵碳水化合物产生的乳酸类细菌[1]。乳酸菌是益生菌的主要来源之一,乳酸菌在胃肠道中繁衍增殖,能够维持肠道菌群动态平衡[2]。因此,分离筛选和挖掘乳酸菌资源对于开发和利用优良菌种资源,促进乳酸菌产业具有重要意义。【前人研究进展】驼乳营养丰富[3]。目前,新疆骆驼存栏约有18.94×104峰,占全国驼峰数的51.36%。原驼乳及自然发酵驼酸乳中益生菌种类多样,且丰度较高,包括各类乳酸菌和酵母菌等。目前研究主要针对自然发酵驼乳中微生物组成、抑菌特性、肠道耐受和免疫调节作用等方面进行了相关研究,其中微生物组成包括Leuconostoc、Lactobacillu、Lactococcus、Streptococcus、Enterococcus等属乳酸菌,以及Kluyveromyces属酵母[4-7]。【本研究切入点】不同地区微生物群落组成存在着明鲜差异,而有关原驼乳中乳酸菌资源相关研究较少。需挖掘乳酸菌资源,并进行分离与筛选,分析菌株的相关特性。【拟解决的关键问题】研究采集新疆乌鲁木齐县近郊南山周边原驼乳样品,分离筛选相关乳酸菌,研究菌株的生长特性、益生功能及食用安全性等,为筛选功能效果优良的乳酸菌资源提供依据。
1 材料与方法
1.1 材 料
1.1.1 原驼乳
采自新疆乌鲁木齐县水西沟镇南山周边驼乳为原驼乳样品。
大肠埃希菌(Escherichia coli) CMCC(B)44102、枯草芽孢杆菌(Bacillus subtilis) CMCC(B)63501、金黄色葡萄球菌(Staphylococcus aureus) CMCC(B)26003、白色念珠菌(Candida albicans) CMCC(F)98、黑曲霉(Aspergillus niger) CMCC(F)98003和扩展青霉(Penicillium expansum) ATCC7861菌株,均由新疆微生物资源保藏管理中心(Microbiological Culture Collection Center of Xinjiang,MCCCX)提供。抗生素滤纸片,购自北京天坛生物制品股份有限公司。
1.1.2 培养基
LB培养基、MRS固体培养基、哥伦比亚血琼脂培养基和蛋白胨水培养基,购自青岛海博生物技术有限公司。
生物胺检测培养基[8]:胰蛋白胨5.0 g,酵母粉5.0 g,柠檬酸铵2.0 g,牛肉膏5.0 g,NaCl 2.5 g, K2HPO4·7H2O 2.0 g, MnSO4 0.05 g,CaCO3 0.1 g,MgSO4 0.2 g,FeSO4 0.04 g,5-磷酸吡哆醛0.05 g,葡萄糖0.5 g,VB1 0.01 g,溴甲酚紫0.06 g,吐温-80 1.0 mL,琼脂20.0 g,蒸馏水1 000 mL,pH(6.0±0.2),1×105 Pa灭菌20 min。
改良氨基脱羧酶检测培养基:在生物胺检测培养基中分别加入浓度为10.0 g/L氨基酸(即精氨酸、色氨酸、酪氨酸、赖氨酸、组氨酸)。
硝基还原酶检测培养基:蛋白胨10.0 g,KNO31.0 g,蒸馏水1 000 mL,pH值7.4左右。
1.2 方 法
1.2.1 菌株分离筛选
分别取1.0 mL新鲜驼乳样品,采用无菌生理盐水按10倍梯度稀释,取100 μL适宜稀释液置于含有1% CaCO3的MRS固体培养基平板上涂布,37 °C恒温倒置培养48 h。观察菌落周围透明圈,并挑取单菌落划线纯化,转接至MRS斜面培养后,4 ℃保存备用。
1.2.2 菌株分子鉴定
采用单菌落克隆方法,以新鲜菌苔为DNA为模板,使用细菌通用引物27F (5′-AGAGTTTGATCCTGGCTCAG-3′)和1 492R (5′-GGTTACCTTGT TACGACTT-3′),进行16S rRNA基因序列PCR扩增,PCR产物经琼脂糖凝胶电泳检测合格后,送至生工生物工程(上海)股份有限公司测序。
将所得序列利用SeqMan (DNAStar 6.0)软件进行序列拼接和人工较正,并在EzTaxon数据库(http://www.ezbiocloud.net/)中比对分析,选取相关模式菌株,使用MEGA 7.0软件进行ClustalX多重比对,并构建相关菌株系统发育树。
1.2.3 菌株生长和产酶特性
菌株的生长和产酶特性参考《常见细菌系统鉴定手册》[9]。以MRS液体培养基为基础,进行菌株生长温度、耐盐、耐酸特性检验;挑取单菌落在乳糖胆盐培养基上划线,观察确定菌株胆盐耐受性;将各乳酸菌点接至相应功能酶筛选培养基上,30 ℃培养3~5 d,观察菌落周围变化。纤维素酶活性观察采用菌落周围滴加0.1%的刚果红染色,再观察菌落周围是否产生透明圈[10,11]。
1.2.4 菌株抗氧化活性
将试验乳酸菌接种至MRS液体培养基,30 ℃,120 r/min条件下恒温振荡48 h后,取10 mL发酵液,4 000 ×g、4 ℃离心15 min;取其上清液测定其DPPH自由基和羟基(OH-)自由基清除能力[12],以1 mg/mL VC作为对照。
1.2.5 菌株抑菌活性
分别将大肠埃希菌、枯草芽孢杆菌、金黄色葡萄球菌、白色念珠菌接种在LB液体培养基中活化培养,取100 μL菌液在MRS固体培养基上均匀涂布,待菌液全部吸收后,点接待测乳酸菌株,于30 ℃培养48 h,观察菌落周围抑菌圈情况。利用无菌生理盐水将青霉及黑曲霉制成孢子悬液,均匀涂布至MRS固体培养基上,待菌液全部吸收,点接待测菌株,于30 ℃培养48 h,观察菌落周围抑菌圈情况。
1.2.6 菌株药敏性评价
菌株药敏性试验参考冯大伟等[13],并结合微生物系统鉴定常用方法,将试验乳酸菌接种至MRS液体培养基,37 ℃,120 r/min恒温振荡培养24 h,取适量发酵菌液,3 000 ×g、4 ℃离心10 min,收集菌体,并用无菌生理盐水重悬,调整菌体浊度为0.5麦氏单位。取100 μL菌液涂布于MRS固体培养基平板上,待菌液吸收后,取抗生素滤纸片分别置于培养基上,于37 ℃培养24 h,观察记录抑菌圈直径大小。
1.2.7 溶血性测定
挑取少量新鲜待测菌株菌苔,划线接种至哥伦比亚血琼脂平板上,37 ℃恒温培养48 h,并观察相关菌株菌落周围的溶血情况。菌落周围有透明的溶血环为β-溶血;菌落周围有草绿色环为α-溶血;菌落周围没有明显溶血变化为γ-溶血,即无溶血性。以金黄色葡萄球菌作为阳性对照[8]。
1.2.8 有害代谢物质检测
生物胺测定以挑取少量新鲜待测菌株菌苔,分别划线接种至改良氨基脱羧酶检测平板和未添加前体氨基酸的平板上,37 ℃恒培养48 h,观察颜色变化,出现紫色为阳性,否则为阴性[13]。吲哚试验和硝基还原酶活性检测分别参照王梦娇[14]和孟丹[15]方法。
1.3 数据处理
试验数据采用Microsoft Excel 2010、Origin 8.0等进行整理及统计分析。
2 结果与分析
2.1 乳酸菌的分离与鉴定
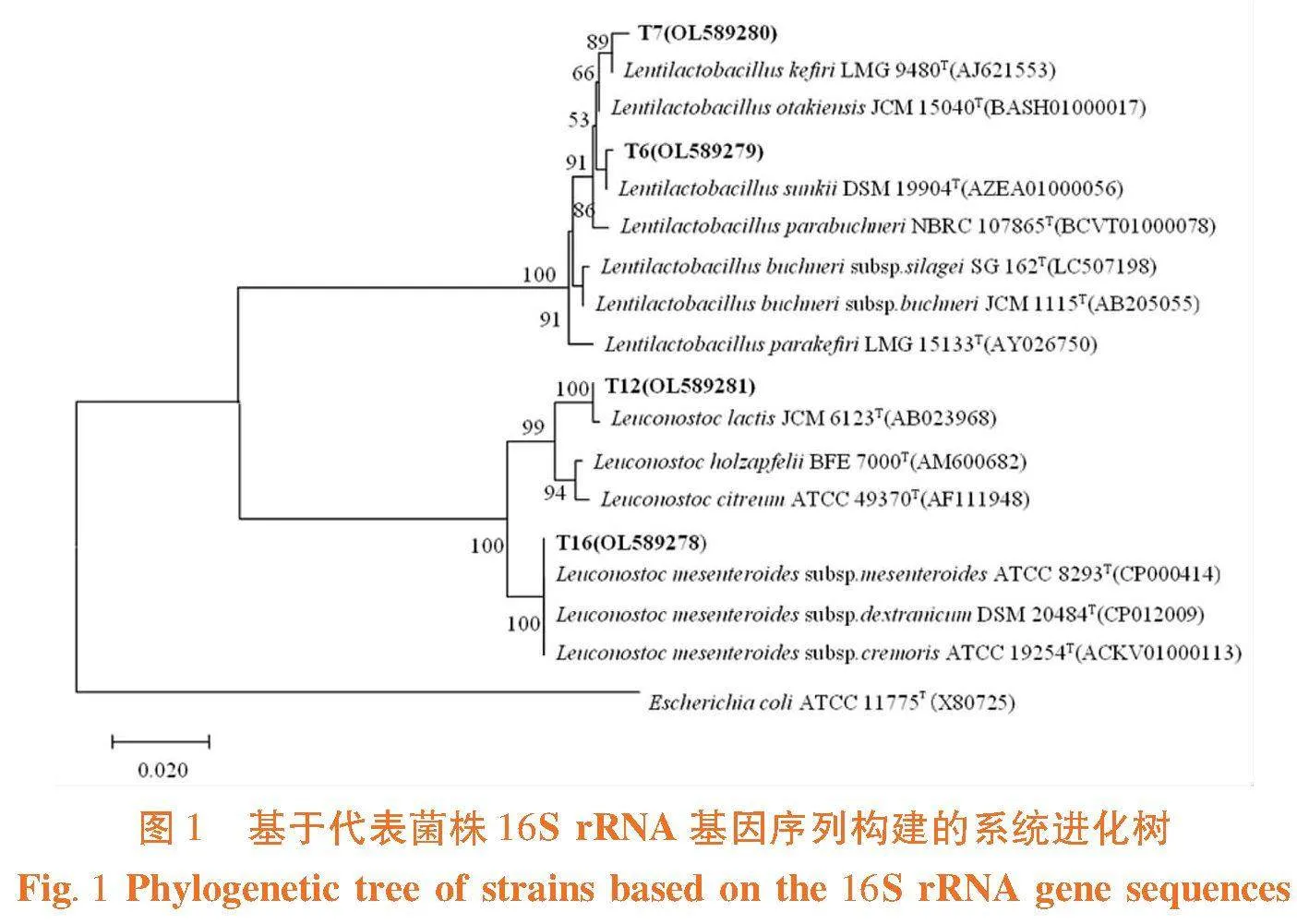
研究表明,获得29株乳酸菌,29株乳酸菌分属于Leuconostoc、Lentilactobacillus 等2个属下的4个种,且均与已知模式种同源性大于99%,其中Lentilactobacillus sunkii 2株占比6.70%,Lentilactobacillus kefiri 3株占比10.34%,Leuconostoc lactis 11株占比37.93%,以及Leuconostoc mesenteroides subsp. mesenteroides 13株占比44.83%,选择代表菌株构建16S rRNA基因序列系统发育树。图1
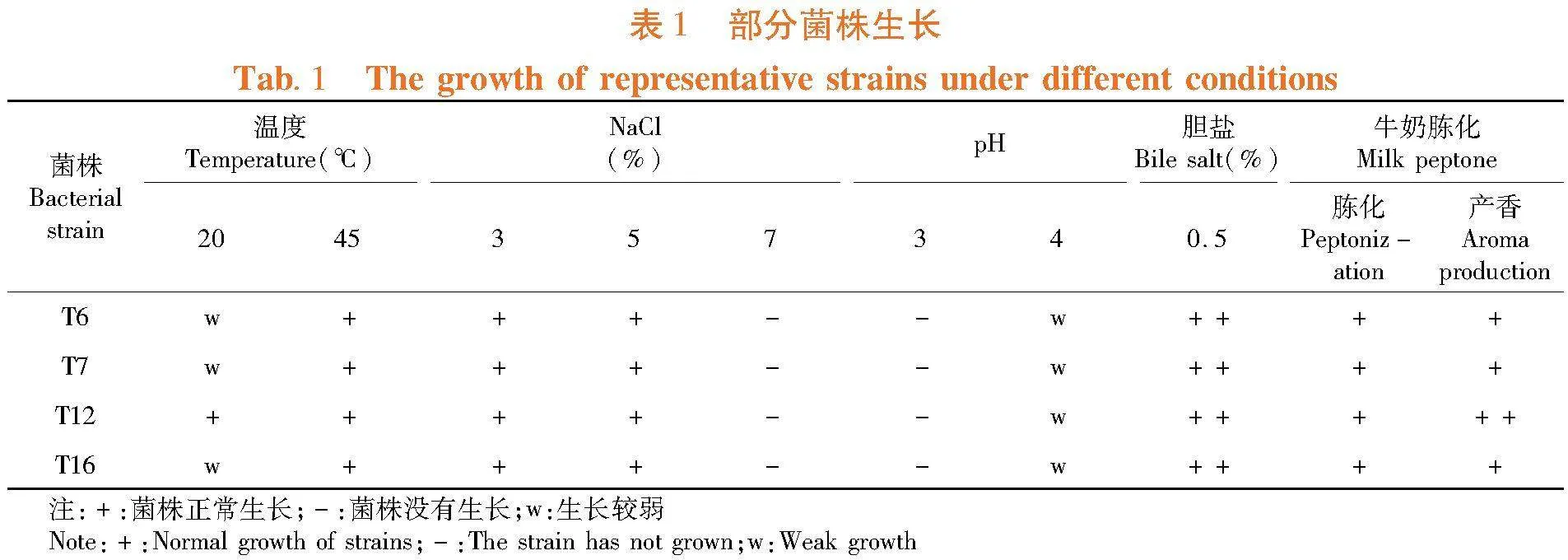
2.2 菌株生长特性
研究表明,29株乳酸菌归为4个种,选取各自代表菌株观测生长状况,4株代表菌株均可在45 ℃生长;均能耐受5% NaCl;均在起始pH 3.0时无明显生长,pH为4时,菌株生长较弱;均可在含0.5% 胆盐培养基上正常生长。均具有较好牛奶胨化能力,无乳清析出;其中,菌株T12发酵牛奶后,酸乳具有浓郁香气,其质地柔和细腻。表1
2.3 菌株的功能性酶活
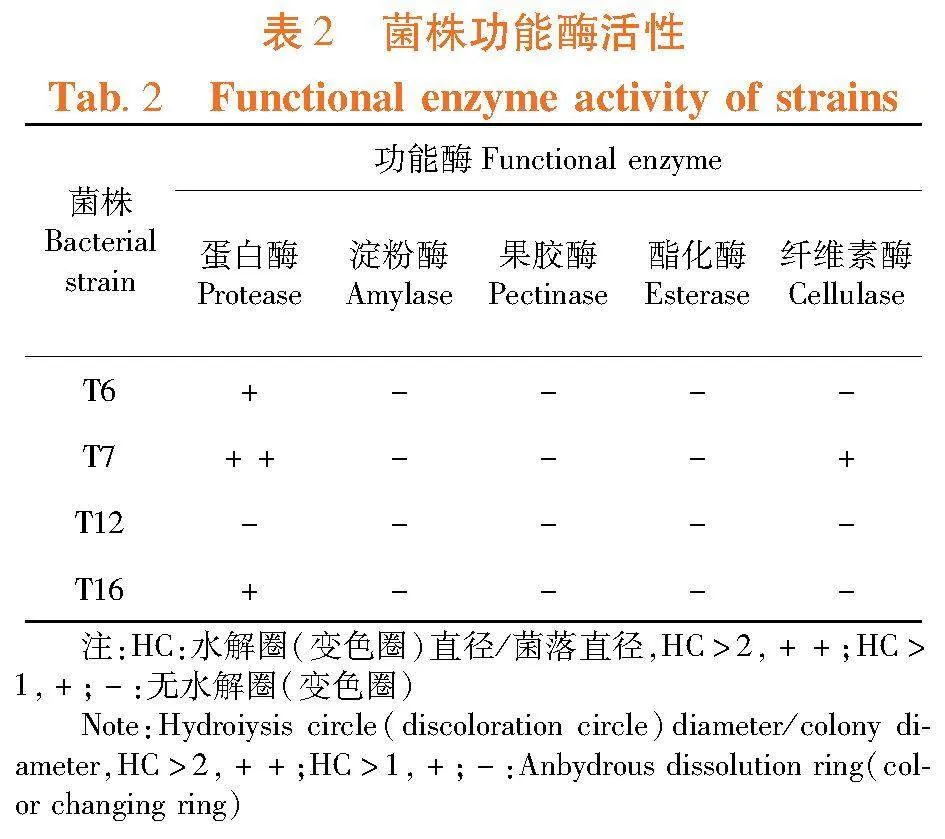
研究表明,4株代表菌除T12外均能产生蛋白酶,其中T7产蛋白酶能力较强;代表菌株均不产生淀粉酶、果胶酶及酯化酶,仅有菌株T7具有产纤维素酶能力。表2
2.4 菌株的抗氧化活性
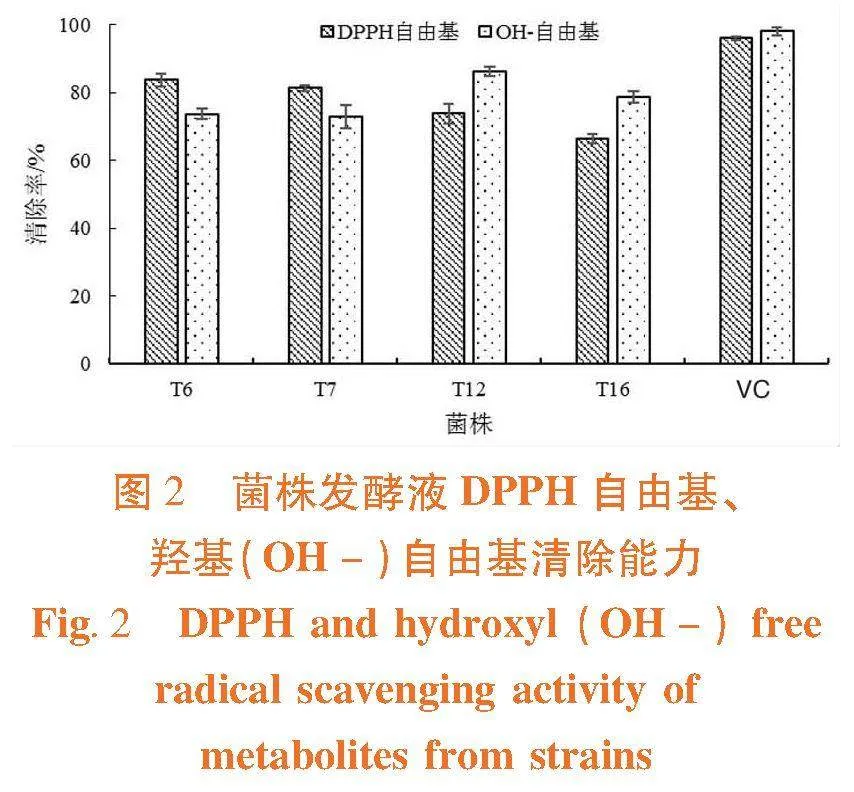
研究表明,4株代表菌株发酵产物均表现出较好的抗氧化能力,DPPH、OH-自由基清除能力均达到60%以上,其中,菌株T6、T7对DPPH清除率达到了80%以上;菌株T12的OH-自由基的清除率最好,达到80%以上。 图2
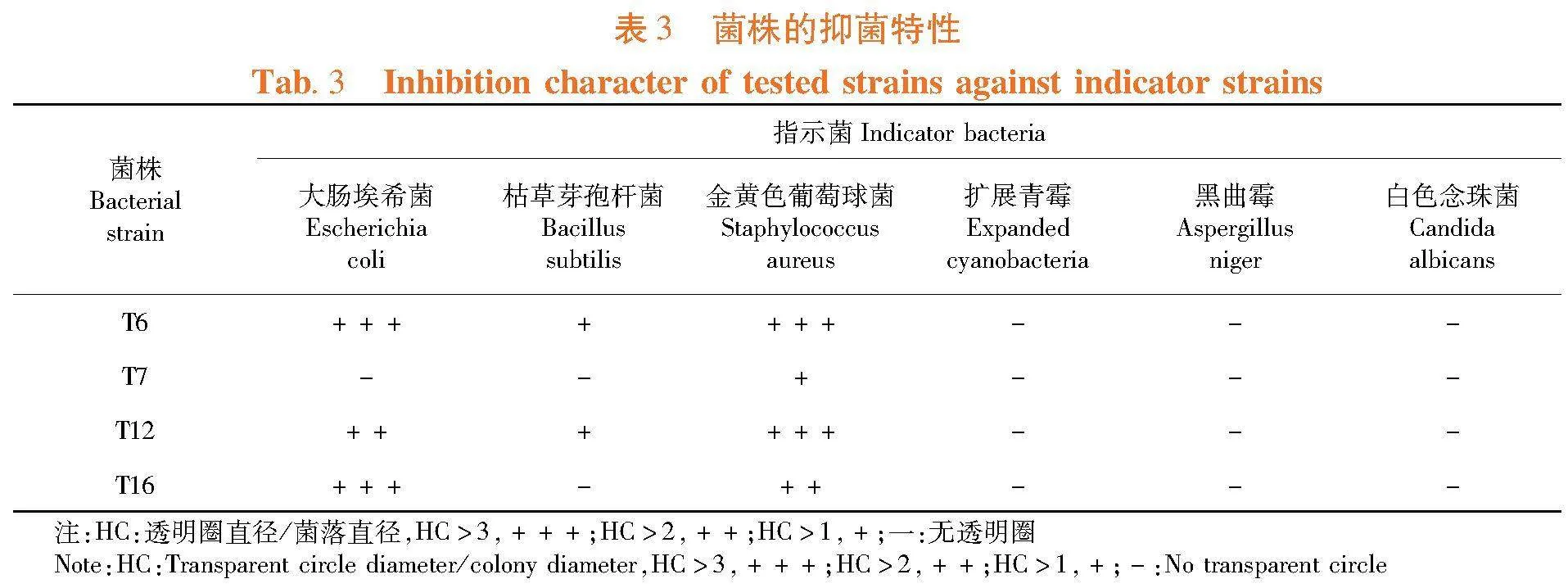
2.5 菌株的抑菌活性
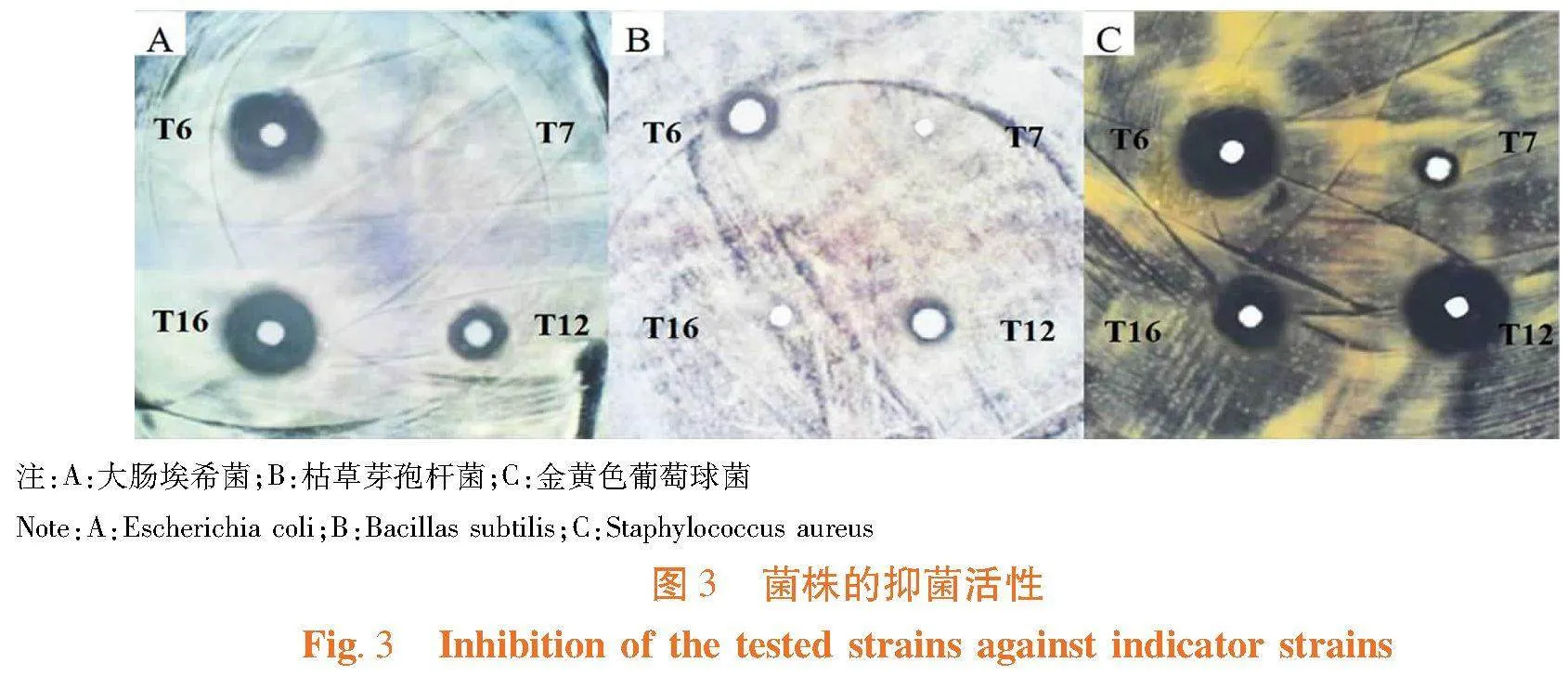
研究表明,4株代表乳酸菌均对金黄色葡萄球菌的抑制作用,其中,T12与T16的抑制作用最强;3株对大肠埃希菌有抑制作用,其中T6和T16的活性较强;实验乳酸菌中仅T6与T12对枯草芽孢杆菌存在抑制作用;所有代表乳酸菌株均对试验真菌无抑制作用。表3,图3
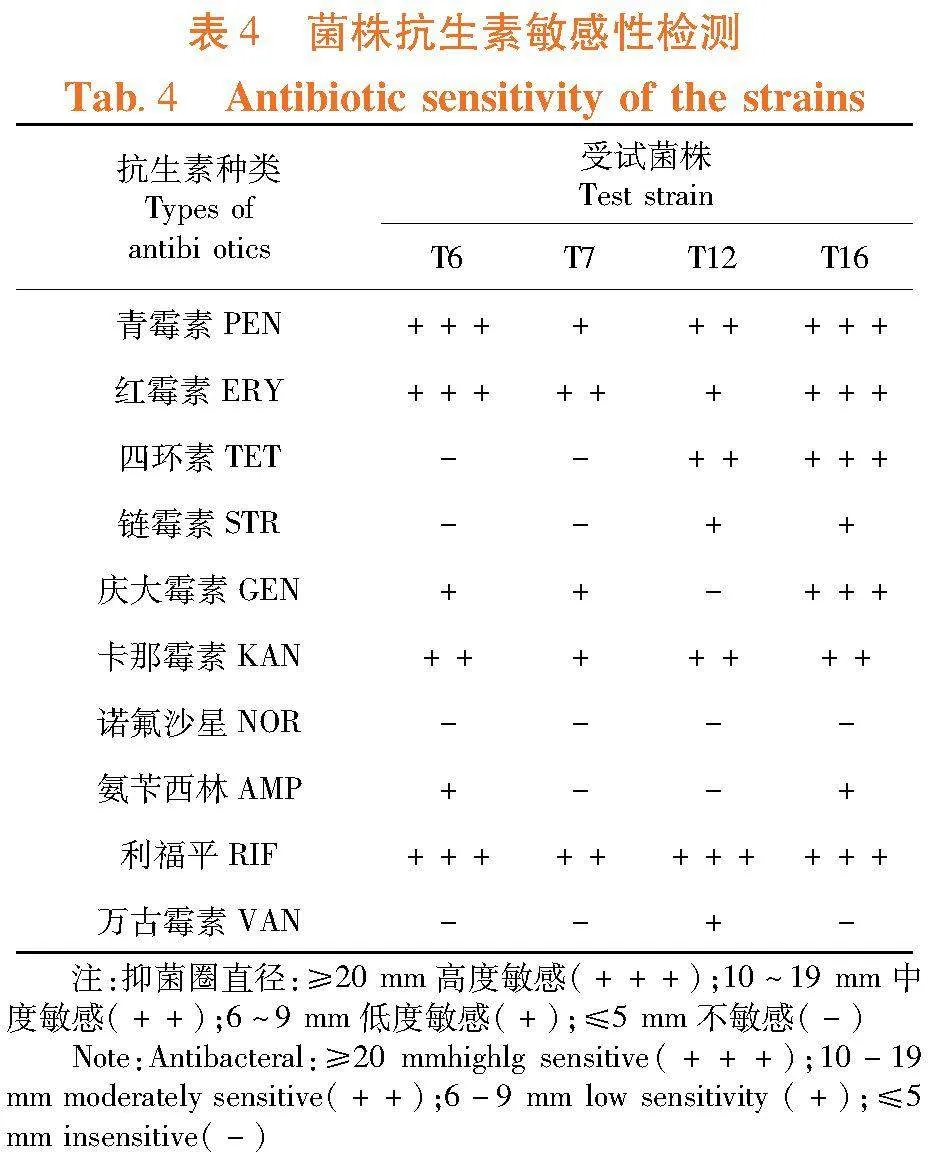
2.6 菌株药敏性评价
研究表明,4株乳酸菌对不同抗生素呈现出不同的药敏性。所有菌株均表现出对青霉素、红霉素、卡那霉素及利福平的敏感性。诺氟沙星对4株乳酸菌抑菌效果最差,4株菌均对诺氟沙星表现出明显耐药性。表4
2.7 有害代谢物质检测
研究表明,除菌株T12能利用L-酪氨酸、L-色氨酸和L-组氨酸产生相应生物胺外,其它菌株均无转胺酶活性。吲哚试验中,仅菌株T12发酵液的液面颜色呈现轻微的玫瑰红色,表明其具有色氨酸酶,可分解蛋白胨中的色氨酸产生吲哚;4株菌株均无硝基还原酶。表5
3 讨 论
3.1 驼酸乳和原驼乳中乳酸菌多样性
驼乳是营养丰富的特色乳品 [16]。驼乳中的微生物含量和多样性较之牛奶高出数倍,往往短时间自然发酵即可形成驼酸乳。
驼酸乳中的优势微生物主要包括乳杆菌如瑞士乳杆菌(L. helveticus)、鼠李糖乳酸杆菌(L. rhamnosus)、干酪乳杆菌干酪亚种(L. casei subsp. casei)、植物乳杆菌(L. plantarum)、短乳杆菌(L. brevis)等,乳球菌中如乳酸乳球菌乳球菌亚种(L. lactis subsp. Lactis),肠球菌如坚韧肠球菌(E. durans),链球菌如唾液链球菌(S. salivarius),明串珠菌如乳酸明串珠菌(L. lactis)等。在驼酸乳中不同区域乳酸菌组成有差异,利用高通量方法对阿拉善自然发酵驼乳菌群进行了分析[4],发现其主要优势菌属是乳杆菌属(Lactobacillus)和醋酸菌属(Acetobacter),而新疆自然发酵驼乳中主要优势菌属为乳杆菌属(Lactobacillus)和乳球菌属(Lactococcus),其中Lactobacillus为绝对优势菌属;在一个相对较小的区域范围内其菌群也有明显组成差异,如对阿拉善牧区驼酸乳研究中[17],仅分离到短乳杆菌(L. brevis),而张哲等[5]分离获得胚芽乳杆菌(L. plantarum)、瑞士乳杆菌(L. helveticus)、开菲尔基质乳杆菌(L. kefiranofaciens)、嗜热链球菌(S. thermophiles)和假肠膜明串球菌(L. pseudomesenteroides)。
张苗苗[18]对我国新疆哈密市9份原驼乳中分离到5个属9个种的乳酸菌,发现不同样品之间存在明显差异,其中,主要菌属为明串球菌属(Leuconostoc)。任冬艳等[19]从我国内蒙古阿拉善盟驼乳中分离获得了乳酸乳球菌(L. lactis)、淡黄肠球菌(E. gilvus)、副干酪乳杆菌(L. paracasei)、肠膜明串珠菌(L. mesenteroides)等, 其中L. lactis为样品的优势菌种。而Khedid等[20]在摩洛哥驼乳中分离到更加多样的乳酸菌,总计涉及 Lactococcus、Leuconostoc 、Enterococcus、Streptococcus 、Pediococcus 等属20个种,其中 Lactobacillus占比最高,种类也最多,包括8个种。研究从我国新疆乌鲁木齐县南山周边原驼乳中分离得到29株乳酸菌,经16S rRNA基因序列分析鉴定为 Leuconostoc、Lentilactobacillus 2个属下的4个种,分别为Lentilactobacillus sunkii、Lentilactobacillus kefiri、Leuconostoc lactis及Leuconostoc mesenteroides subsp. Mesenteroides。
3.2 乳酸菌特性及食品安全
胃肠道中存在的胃酸及胆汁,乳酸菌必须具有一定的耐酸和耐胆盐能力[21, 22]。研究分离出的4种乳酸菌均表现出耐受0.5%胆盐,5%NaCl的能力,具有一定耐酸性,但一般情况胃酸pH 2.0~2.5,消化停留约3 h。同时,4种乳酸菌在试验中均表现出了良好的抗氧化能力。乳酸菌可以起到与抗氧化剂相近的作用,乳酸菌能通过清除体内的超氧阴离子及过氧化氢等,从而起到降低机体氧化损伤、预防病变及延缓衰老的作用,是一种新型的天然抗氧化剂[23, 24]。
蔡静静等[25]在新疆伊犁乳制品中分离得到的乳酸菌可以对大肠埃希氏菌起到一定的抑制作用。LYU等 [26]从新疆传统驼酸乳中分离筛选得到的干酪乳杆菌TN-2,具有较强的产细菌素能力,对食源性致病菌株表现出了广谱抗菌作用。研究中4株乳酸菌对金黄色葡萄球菌均有抑制作用,但不同菌株之间的抑菌能力存在较大差别,Lentilactobacillus的2株菌的抑制能力要高于Leuconostoc, T6与T12的抑菌范围更为广泛,对3种常见病原细菌有明显抑制作用。
鉴定乳酸菌的抗生素敏感性,是乳酸菌安全性评估与使用的必要部分[27]。万倩等[28]对38株乳酸菌进行耐药性分析,发现其分别对25种抗生素展现出不同的耐药性,并检测出部分耐药基因的携带。药敏试验发现,4株乳酸菌均表现出对青霉素、红霉素、卡那霉素及利福平的敏感性,与热孜姑丽·库尔班等[29]研究结果基本一致。
研究中4株乳酸菌均不溶血,且不产生硝基还原酶,仅菌株T12能产生生物胺,并且吲哚检测试验呈弱阳性。生物胺在动植物体内承担着重要的生理功能,适量的生物胺可以对神经系统起到重要作用,但摄入过量生物胺会引起中毒反应。同时,生物胺也会与亚硝酸盐反应生成如亚硝胺等物质[30]。吲哚试验能检测出菌株是否具有分解蛋白质中色氨酸的能力[31]。闫肃等[32]在对不同食物来源的乳酸菌进行安全性评价过程中,发现有少量乳酸菌具有溶血的能力,此外,还发生过由乳酸菌引起的新生儿菌血症感染事件[33]。
4 结 论
从新疆乌鲁木齐县南山周边原驼乳样品中分离得到29株乳酸菌,经分子鉴定分别为分别为Lentilactobacillus sunkii、Lentilactobacillus kefiri、Leuconostoc lactis及Leuconostoc mesenteroides subsp. Mesenteroides等2个属4个种,其中Lentilactobacillus sunkii在驼乳和驼酸乳中均发现。4种乳酸菌均具有较好胆盐和NaCl耐受性,发酵液具有良好的抗氧化能力,且呈不同程度的抑菌特性,均不溶血,且不产生硝基还原酶,且有良好的益生特性和食品安全性。
参考文献(References)
[1]Burgain J, Scher J, Francius G, et al. Lactic acid bacteria in dairy food: surface characterization and interactions with food matrix components[J]. Advances in Colloid and Interface Science, 2014, 213: 21-35.
[2] Evivie S E, Huo G C, Igene J O, et al. Some current applications, limitations and future perspectives of lactic acid bacteria as probiotics[J]. Food amp; Nutrition Research, 2017, 61(1): 1318034.
[3] 郝晓丽. 驼乳和牛乳乳清蛋白抗氧化活性的比较分析及其应用研究[D]. 呼和浩特: 内蒙古农业大学, 2020.HAO Xiaoli. Comparative analysis and application of antioxidant activity of whey protein from camel milk and bovine milk[D]. Huhhot: Inner Mongolia Agricultural University, 2020.
[4] 张苗苗, 倪永清. 新疆哈密地区原驼乳中乳酸菌多样性分析[J]. 安徽农业科学, 2019, 47(15): 163-166, 182.ZHANG Miaomiao, NI Yongqing. Biodiversity of lactic acid bacteria isolated from camel milk of Hami Area in Xinjiang[J]. Journal of Anhui Agricultural Sciences, 2019, 47(15): 163-166, 182.
[5] 张哲, 刘小鸣, 陈卫. 内蒙古传统发酵驼乳中乳酸菌和酵母菌的分离鉴定及其生物多样性分析[J]. 中国食品学报, 2018, 18(7): 230-238.ZHANG Zhe, LIU Xiaoming, CHEN Wei. Isolation and identification of lactic acid bacteria and yeast and biodiversity analysis of traditional fermented camel milk in Inner Mongolia[J]. Journal of Chinese Institute of Food Science and Technology, 2018, 18(7): 230-238.
[6] FAHAD Shah, 徐鸿洋, 智超, 等. 阿拉善双峰驼酸驼乳中乳酸菌的分离鉴定及耐酸和耐盐研究[J]. 食品研究与开发, 2020, 41(18): 189-194.SHAH F, XU Hongyang, ZHI Chao, et al. Separation, Identification, Acid-Resistent and Halotolerant Characterization of Lactic acid bacteria from Shubat of Alashan Bactrian Camel[J]. Food Research and Development, 2020, 41(18): 189-194.
[7] 拉提帕·艾尔肯. 新疆传统发酵驼乳中发酵菌的分离鉴定及免疫调节作用[D].乌鲁木齐:新疆医科大学,2013.Latipa Aierken. Isolation and identification of zymocyte from the traditional fermentation of camel milk in Xinjiang and immune adjustment effect[D].Urumqi: Xinjiang Medical University, 2013.
[8] 林杨, 顾美英, 孙建, 等. 阿克苏地区传统酸乳中乳酸菌筛选及安全性初步评价[J]. 微生物学杂志, 2022, 42(1): 26-33.LIN Yang, GU Meiying, SUN Jian, et al. Screening and safety evaluation of lactobacteria from traditional yogurt in Aksu Region[J]. Journal of Microbiology, 2022, 42(1): 26-33.
[9] 东秀珠, 蔡妙英. 常见细菌系统鉴定手册[M]. 北京: 科学出版社, 2001: 364-370.DONG Xiuzhu, CAI Miaoying. Handbook of identification of common bacterial systems[M]. Beijing: Science Press, 2001: 364-370.
[10] 刘晓静, 楚敏, 朱静, 等. 库车小白杏内生细菌多样性及其产酶特性[J]. 食品科学, 2020, 41(14): 203-209.LIU Xiaojing, CHU Min, ZHU Jing, et al. Diversity and functional enzymes of endophytic bacteria in kuqa apricot[J]. Food Science, 2020, 41(14): 203-209.
[11] 林杨. 高产γ-氨基丁酸乳酸菌的选育及其发酵工艺优化[D]. 乌鲁木齐: 新疆农业大学, 2021.LIN Yang. Breeding of lactic acid bacteria with high yield of γ -aminobutyric acid and optimization of its fermentation technology[D].Urumqi: Xinjiang Agricultural University, 2021.
[12] 李权威, 张开屏, 赵艳红, 等. 风干羊肉中乳酸菌的体内外抗氧化特性[J]. 微生物学通报, 2020, 47(12): 4094-4104.LI Quanwei, ZHANG Kaibing, ZHAO Yanhong, et al. Antioxidation properties in vitro and in vivo of Lactobacillus in air-dried mutton[J]. Microbiology China, 2020, 47(12): 4094-4104.
[13] 冯大伟, 周家春. 益生乳酸菌的纸片扩散法药敏性试验评价[J]. 微生物学通报, 2010, 37(3): 454-464.FENG Dawei, ZHOU Jiachun. Evaluation of agar disc diffusion method for determining antibiotic susceptibility of lactic acid bacteria strains by a selected culture medium[J]. Microbiology China, 2010, 37(3): 454-464.
[14] 王梦姣. 内蒙古牧区马奶及其制品中肠球菌属乳酸菌安全性评价[D]. 呼和浩特: 内蒙古农业大学, 2014.WANG Mengjiao. Safety Evaluation of Lactic Acid Bacteria Isolated from Mares Milk and Its Products in Pastoral Areas of Inner Mongolia[D]. Hohhot: Inner Mongolia Agricultural University, 2014.
[15] 孟丹, 王丽群, 谢国梁, 等. 一株乳酸乳球菌产γ-氨基丁酸能力及其安全性评价[J]. 中国酿造, 2017, 36(4): 72-77.MENG Dan, WANG Liqun, XIE Guoliang, et al. γ-aminobutyric acid-producing ability and safety evaluation of Lactococcus lactis[J]. China Brewing, 2017, 36(4): 72-77.
[16] 王瑞雪, 伊丽, 吉日木图. 驼乳生物活性肽的研究进展[J]. 中国食品学报, 2020, 20(7): 299-306.WANG Ruixue, YI Li, Jirimutu. Research progress on the bioactive peptides in camel milk[J]. Journal of Chinese Institute of Food Science and Technology, 2020, 20(7): 299-306.
[17] 张七斤, 吕天星, 于晨龙, 等. 酸驼乳中益生乳酸菌的分离筛选[J]. 畜牧与饲料科学, 2017, 38(8): 1-5.ZHANG Qijin, LYU Tianxing, YU Chenlong, et al. Isolation and screen of probiotic lactic acid bacteria from traditional fermented camel milk[J]. Animal Husbandry and Feed Science, 2017, 38(8): 1-5.
[18] 张苗苗. 新疆哈密地区原驼乳中乳酸菌多样性及产细菌素菌株的筛选[D]. 石河子: 石河子大学, 2019.ZHANG Miaomiao. Diversity of Lactic Acid Bacteria(LAB) in Raw Camel Milk in Hami Area of Xinjiang and Screening of Bacteriocin-Producing LAB Strains[D]. Shihezi: Shihezi University, 2019.
[19] 任冬艳, 李磊, 李翠平, 等. 驼奶中乳酸菌的分离鉴定[J]. 食品安全导刊, 2021,(32): 96-98.REN Dongyan, LI Lei, LI Cuiping, et al. Isolation and identification of lactic acid bacteria from camel milk[J]. China Food Safety Magazine, 2021,(32): 96-98.
[20] Khedid K, Faid M, Mokhtari A, et al. Characterization of lactic acid bacteria isolated from the one humped camel milk produced in Morocco[J]. Microbiological Research, 2009, 164(1): 81-91.
[21] Jans C, Bugnard J, Njage P M K, et al. Lactic acid bacteria diversity of African raw and fermented camel milk products reveals a highly competitive, potentially health-threatening predominant microflora[J]. LWT, 2012, 47(2): 371-379.
[22] Saini K, Tomar S K. Invitro evaluation of probiotic potential of Lactobacillus cultures of human origin capable of selenium bioaccumulation[J]. LWT, 2017, 84: 497-504.
[23] Ji K, Jang N Y, Kim Y T. Isolation of lactic acid bacteria showing antioxidative and probiotic activities from kimchi and infant feces[J]. Journal of Microbiology and Biotechnology, 2015, 25(9): 1568-1577.
[24] Reuben R C, Roy P C, Sarkar S L, et al. Isolation, characterization, and assessment of lactic acid bacteria toward their selection as poultry probiotics[J]. BMC Microbiology, 2019, 19(1): 253.
[25] 蔡静静, 张亚川, 李谞, 等. 新疆伊犁地区乳制品中乳酸菌发酵和益生特性及其复合发酵方案优化[J]. 食品科学, 2020, 41(18): 172-179.CAI Jingjing, ZHANG Yachuan, LI Xu, et al. Fermentation and probiotic properties of lactic acid bacteria isolated from dairy products in Yili, Xinjiang and optimization of their mixtures for mixed-culture fermentation[J]. Food Science, 2020, 41(18): 172-179.
[26] LYUX, Hu P, Dang Y, et al. Purification and partial characterization of a novel bacteriocin produced by Lactobacillus casei TN-2 isolated from fermented camel milk (Shubat) of Xinjiang Uygur Autonomous Region, China[J]. Food Control, 2014, 43: 276-283.
[27] 王磊, 高宗露, 宗丽娜, 等. 酸乳用乳酸菌抗生素耐药性研究[J]. 食品研究与开发, 2021, 42(6): 162-169.WANG Lei, GAO Zonglu, ZONG Lina, et al. Study on antibiotic resistance of lactic acid bacteria for yoghurt[J]. Food Research and Development, 2021, 42(6): 162-169.
[28] 万倩, 李启明, 吴华星, 等. 传统发酵食品中乳酸菌的安全性评估[J]. 现代食品科技, 2021, 37(6): 276-286.WAN Qian, LI Qiming, WU Huaxing, et al. Evaluation for lactic acid bacteria safety in traditional fermented food[J]. Modern Food Science and Technology, 2021, 37(6): 276-286.
[29] 热孜姑丽·库尔班, 潘庆珉, 申彤, 等. 新疆阿勒泰地区传统酸驼乳中益生乳酸菌的体外筛选[J]. 食品科技, 2021, 46(7): 48-54.Reziguli Kuerban, PAN Qingmin, SHEN Tong, et al. In vitro screening of lactic acid bacteria with probiotic properties from spontaneously fermented camel milk in Altay, Xinjiang[J]. Food Science and Technology, 2021, 46(7): 48-54.
[30] 李晓颖, 刘虹, 张颜廷, 等. 5株植物乳杆菌生物学特性及安全性评价[J]. 食品工业科技, 2017, 38(20): 115-119, 124.LI Xiaoying, LIU Hong, ZHANG Yanting, et al. Biological characteristics and safety evaluation of five Lactobacillus plantarum strains[J]. Science and Technology of Food Industry, 2017, 38(20): 115-119, 124.
[31] Sadok I, Tyszczuk-Rotko K, Mroczka R, et al. Simultaneous voltammetric analysis of tryptophan and kynurenine in culture medium from human cancer cells[J]. Talanta, 2020, 209: 120574.
[32] 闫肃, 李慧敏, 张晓冬, 等. 不同食物来源乳酸细菌的安全性评价[J]. 食品与发酵工业, 2018, 44(5): 82-89.YAN Su, LI Huimin, ZHANG Xiaodong, et al. Safety assessment of lactic acid bacteria from different food products[J]. Food and Fermentation Industries, 2018, 44(5): 82-89.
[33] Bertelli C, Pillonel T, Torregrossa A, et al. Bifidobacterium longum bacteremia in preterm infants receiving probiotics[J]. Clinical Infectious Diseases, 2015, 60(6): 924-927.

