
摘 要:【目的】挖掘干旱区放线菌天然产物代谢潜力,筛选群体感应抑制活性的产物,研究其对梨火疫病原菌毒力因子代谢能力的影响。
【方法】利用紫色杆菌(Chromobacterium violaceum 026, CV026)群体感应抑制活性筛选模型,对新疆库木塔格沙漠周边干旱地区土壤中分离的放线菌进行发酵,采用牛津杯法对其发酵液进行活性筛选;鉴定群体感应抑制活性菌株及验证其发酵液提取和活性,分析粗提液对欧文氏菌毒力因子代谢影响,并采用液质联用(liquid chromatography and mass spectrometry, LC-MS)方法检测菌株代谢产物活性物质,挑选相似结构化合物验证群体感应抑制活性。
【结果】获得一株具有明显群体感应抑制活性菌株K-9,其与Streptomyces rubradiris strain NBRC 14000T相似性达到99.72%。该菌发酵粗提液具有明显的群体感应抑制活性,可有效降低紫色杆菌CV026产紫色素和梨火疫病原菌的游动能力,并对梨火疫病原菌生物膜、胞外多糖和胞外酶等毒力因子产生具有显著抑制活性,呈明显的浓度依赖性;从链霉菌K-9粗提液中得到635种化合物,苯基丙烯酸、4-羟基-3甲氧基苯甲酸等5种明显群体感应抑制化合物。
【结论】干旱区放线菌K-9为Streptomyces rubradiris,其发酵代谢产物具有明显群体感应抑制活性,能显著抑制欧文氏菌毒力因子的产生,并发现了多种新型的群体感应抑制活性化合物。
关键词:群体感应抑制剂;干旱地区放线菌;欧文氏菌;毒力因子
中图分类号:S188 文献标志码:A 文章编号:1001-4330(2024)04-1011-10
0 引 言
【研究意义】群体感应抑制剂(Quorum sensing inhibitor, QSI)是一种可以阻断群体感应通路的化学物质[1]。群体感应参与许多重要的生物学过程,如孢子形成、毒力和生物膜形成等[2],还可引起动植物发病、食物腐败等[3]。群体感应抑制剂可通过对群体感应信号分子合成酶抑制,或产生信号分子类似物竞争结合转录蛋白受体等,阻断群体感应通路,降低病原菌抗药性、毒力因子代谢等,且不会给病原菌带来明显的生存压力[4-5]。【前人研究进展】梨火疫病危害香梨和苹果[6];梨火疫病原菌解淀粉欧文氏菌(Erwinia amylovora)是一种革兰氏阴性菌,能够引起梨、苹果及其他蔷薇科植物火疫病,使植物叶、花、果实以及枝干快速枯萎、变黑,导致农作物减产[7]。欧文氏菌的毒力因子与生物膜、胞外多糖、胞外酶等代谢产生及其运动性均与群体感应系统相关,其中LuxI/LuxR信号系统主要调控一些蛋白酶、毒力因子的表达,LuxS/LuxO信号系统与植物细胞壁降解酶产生有关,并可以提高环境适应度[8, 9]。
【本研究切入点】
目前,主要以细菌来源为主,如杀黄胞链霉菌能够抑制胡萝卜软腐欧文氏菌所引起的软腐作用[10];芽胞杆菌 240B1 菌株产生的N-酰基高丝氨酸内酯酶可以降低胡萝卜软腐欧文氏菌的致病性[11]。放线菌可以代谢丰富多样的天然活性产物,现已从多种特殊环境放线菌中分离获得群体感应抑制剂[12-13]。目前,常用的群体感应抑制剂筛选模型紫色杆菌CV026,当添加群体感应抑制剂时可阻断或破坏信号分子传递通路,从而抑制紫色杆菌CV026紫色素产生,但不抑制其生长,从而形成无紫色色素的模糊透明圈[14]。欧文氏菌具有和紫色杆菌CV026相类似的群体感应信号分子,通过该模型可对欧文氏菌群体感应抑制剂进行有效的筛选。目前,有关欧文氏菌群体感应抑制剂相关研究的报道较少,需研究挖掘干旱区放线菌天然产物代谢潜力,筛选群体感应抑制活性的产物。【拟解决的关键问题】从库木塔格沙漠周边干旱区土壤中分离出一批放线菌资源,通过紫色杆菌CV026筛选模型筛选,发现一株具有较强群体感应活性的菌株K-9,鉴定菌株,并对其发酵产物进行提取,检验粗提物对欧文氏菌群集性和泳动性的影响及其生物膜、胞外多糖、胞外酶产量的抑制作用,为菌株K-9群体感应抑制活性分子分析及应用奠定基础。
1 材料与方法
1.1 材 料
1.1.1 菌 株
紫色杆菌CV026由中国海洋大学海洋生命学院王岩教授惠赠; 梨火疫病原菌解淀粉欧文氏菌(Erwinia amylovora)由新疆微生物资源保藏管理中心提供。
1.1.2 试 剂
二甲基亚砜(DMSO),结晶紫,乙酸乙酯,蒽酮,N-己酰基-L-高丝氨酸内酯标准品(C6-HSL)均购自北京鼎国昌盛生物技术有限责任公司; DL-4-羟基苯乳酸水合物,3,4-二羟苯基丙酸均购自上海麦克林生化科技有限公司;苯基丙烯酸、哌啶酸、4-羟基-3,5-二甲氧基苯甲酸购自北京阳光峰行化学研究有限公司; 4-羟基-3甲氧基苯甲酸均购自北京坛墨质检科技有限公司; 2-吡咯羧酸、甘氨酸三甲胺内盐均购自河北百灵威超精细材料有限公司。
1.1.3 培养基
高氏一号培养基,贝耐特培养基, ISP2培养基和LB培养基,购自北京鼎国昌盛生物技术有限责任公司。
群集检测培养基(g/L):蛋白胨 10.0,葡萄糖 5.0,NaCl 5.0,琼脂5.0,pH自然。
泳动检测培养基(g/L):胰蛋白胨10.0,NaCl 3.0,琼脂5.0,pH自然。
1.1.4 器 材
PLCD离心机(德国希格玛公司);SPX-250BF恒温培养箱(上海福玛实验设备有限公司);R300旋转蒸发仪(河南巩义市英裕予华公司);Biotek Epoch-2型酶标仪(美国伯腾仪器有限公司);SW-CJ-1F超净工作台(苏州安泰空气技术有限公司);BSD-250振荡培养箱(上海博讯实业有限公司医疗设备厂);Silica gel 60 F254薄层铝板(德国默克公司)。
1.2 方 法
1.2.1 QSI活性放线菌的筛选
从新鲜待测放线菌菌株斜面上刮取表面孢子,接种至含有50 mL高氏一号液体培养基的250 mL三角瓶中,30 ℃,150 r/min恒温振荡培养7 d。发酵液经双层滤纸抽滤后,用0.22 μm滤膜过滤,收集滤液,保存于-20 ℃,备用。
取紫色杆菌CV026新鲜菌苔一环接入LB中, 30 ℃ ,150 r/min恒温振荡培养16 h。取1 mL CV026菌液和20 μL 100 μmol/mL C6-HSL加入平皿中,加入25 mL LB固体培养基(约50 ℃),迅速混匀,放入外径8 mm牛津杯,等培养基凝固,备用。
取100 μL发酵滤液加入孔中,并以无菌水为对照,30 ℃正置恒温培养24 h,观察平板变色情况,并记录有模糊透明圈的菌株。
1.2.2 放线菌的形态及分子鉴定
将筛选获得菌株划线于高氏一号固体培养基平板上, 30 ℃恒温培养 4 d,观察菌落形态大小、颜色等形态。
菌株基因组DNA按照试剂盒(TIANamp Bacteria DNA Kit)说明书提取,PCR采用细菌16S rRNA基因序列通用引物27F(5′-AGAGTTTGATCCTGGCTCAG-3′)和1492R(5′-GGTTACCTTGTTACGACTT-3′),反应条件为 95 ℃预变性 5 min; 94 ℃变性 30 s,54 ℃退火 30 s, 72 ℃延伸 1 min,30个循环; 72 ℃延伸10 min。PCR 扩增产物经琼脂糖凝胶电泳检测,纯化后,由北京鼎国昌盛生物技术有限责任公司测序。
1.2.3 粗提物制备及其功能验证
菌株接种至高氏一号液体培养基,30 ℃,150 r/min恒温振荡培养7 d, 发酵液离心,取上清液,等体积乙酸乙酯萃取3 h,取有机相40 ℃真空旋转蒸发仪中蒸干,称重,获得粗提物。称取适量粗提物溶解于二甲基亚砜中配制成一定浓度,有机溶剂滤膜过滤,滤液保存于-20 ℃,备用。
粗提液群体感应活性验证采用薄层色谱(TLC)-生物自显影法[15]。取5 μL粗提物点在铝制薄层板上,选用展开剂体系为甲醇-乙酸乙酯-三氯甲烷-石油醚(体积比10∶50∶1∶1),密闭层析至上端0.5 cm,冷风吹干,置于紫外线灯254 nm观察荧光斑点 ,并拍照。将混有紫色杆菌CV026和C6-HSL的LB琼脂铺于TLC板上,凝固后, 30℃恒温培养36 h,观察平板变色情况,并拍照。
1.2.4 不同浓度粗提液的抑菌情况
采用96孔板法,分别接种对数中后期的紫色杆菌CV026和梨火疫病原菌,按2%接种量接种于含有不同浓度粗提物的LB液体培养基中,其中粗提物的终浓度分别为0.15、0.3、0.6、1.25、2.5、5、10 mg/mL,并以加入等体积二甲基亚砜作为对照,等体积无菌水为阴性对照。各处理设3个平行,置于酶标仪中30 ℃震荡培养24 h,每2 h测定OD590值,观察粗提物的抑菌情况。
1.2.5 粗提液对紫色杆菌产紫色色素的影响
采用96孔板法,分别取 120 μL的LB液体培养基(含 0.1 μmol C6-HSL )置于孔中,以 2%接种量接种CV026菌液,分别加入适量的粗提液,至0.15、0.3、0.6、1.25、2.5 mg/mL,并以加入等量的二甲基亚砜为对照,置于酶标仪中30 ℃震荡培养24 h。采用Choo等[16]方法,分别吸取上述发酵液100 μL置于1.5 mL离心管中,10 000 r/min室温离心5 min,弃上清,加100 μL的DMSO涡旋震荡混匀,并使紫色杆菌紫色素充分溶解后,离心取上清液,运用酶标仪测定其 OD600值,分析粗提物对紫色杆菌产生紫色素的影响。
1.2.6 粗提液对梨火疫病原菌生物膜的影响
采用96孔板法,分别取120 μL LB液体培养基于孔中,以2%的接种量接入梨火疫病原菌菌液,分别加入一定量的粗提物,至终浓度为0.5、1、2、5 mg/mL, 并以加入等量的二甲基亚砜为对照,置于酶标仪中30 ℃震荡培养24 h。参考Zhang等[17]弃掉菌液,蒸馏水冲洗3次获得生物膜,自然风干后用1%结晶紫染色15 min,冲洗干净并烘干,用95%的乙醇洗脱,测定OD590值。
1.2.7 粗提液对梨火疫病原菌胞外多糖的测定
参考于福浩等[18]方法,吸取100 μL菌液上清液,加入乙酸乙酯萃取2次,40 ℃蒸干,加入100 μL超纯水溶解后用 300 μL 2%蒽酮-硫酸溶液进行显色反应,在沸水中反应 15 min并冷却,设立空白对照组,重复3次,测定样品与空白对照组的 OD625 值。
1.2.8 粗提液对梨火疫病原菌蛋白酶产量测定
取100 μL菌液10 000 r/min常温离心8 min,取上清,加入200 μL 1.3%的脱脂牛奶溶液(w/v,50 mmol/L K2HPO4,pH值 7.0),37℃,静置2 h,测量OD600。
1.2.9 粗提液对梨火疫病原菌群集性和泳动性的影响
参考刘佳宜等[19]方法,分别配制含有0.6、1.2、2.5、5 mg/mL粗提物的群集琼脂培养基和泳动琼脂培养基平板,以添加等体积的二甲基亚砜为对照,点接梨火疫病原菌,30 ℃恒温正置培养 24 h,观察菌株的群集和泳动情况。
1.2.10 LC-MS检测及化合物群体感应抑制活性验证
将菌株K-9发酵粗提物送至苏州帕诺米克生物医药科技有限公司进行LC-MS检测,色谱条件:正离子流动相为 0.1%甲酸乙腈(B2)和 0.1%甲酸水(A2),梯度洗脱顺序为2% B2,0~1 min;2%~50% B2,1~9 min;50%~98% B2,9~12 min;98% B2,12~13.5 min;98%~2% B2,13.5~14 min;2% B2,14~20 min。负离子流动相为乙腈(B3)和 5 mM 甲酸铵水(A3),梯度洗脱顺序为2% B3,0~1 min;2%~50% B3,1~9 min;50%~98% B3,9~12min;98% B3,12~13.5 min;98%~2% B3,13.5~14 min;2% B3,14~17 min。流速:0.25 mL/min,柱温:40 ℃,进样量 2 μL[20]。
质谱主要条件:采用电喷雾离子源(ESI),正离子喷雾电压为 3.50 kV,负离子喷雾电压为-2.50 kV,毛细管温度 325 ℃。以分辨率 70 000 进行一级扫描,一级离子扫描范围100~1 000 m/z,并采用高能碰撞诱导裂解模式(HCD)进行二级裂解,碰撞能量为 30 eV,二级分辨率为 17 500[21]。
选取部分潜在功能化合物,将化合物标准品浓度配制为10 mg/mL,功能验证。取100 μL标准品溶液加至紫色杆菌CV026模型筛选培养基打孔处,并以无菌水为对照,30 ℃正置恒温培养24 h,观察平板变色情况,记录有模糊透明圈直径。
1.3 数据处理
将所得菌株16S rRNA 基因序列上传至 NCBI数据库进行比对,并调取相关相似性模式菌株序列,利用 MEGA 7软件进行Neighbor-Joining系统进化树构建,确定其分类地位。
2 结果与分析
2.1 群体感应抑制活性菌株的筛选及鉴定
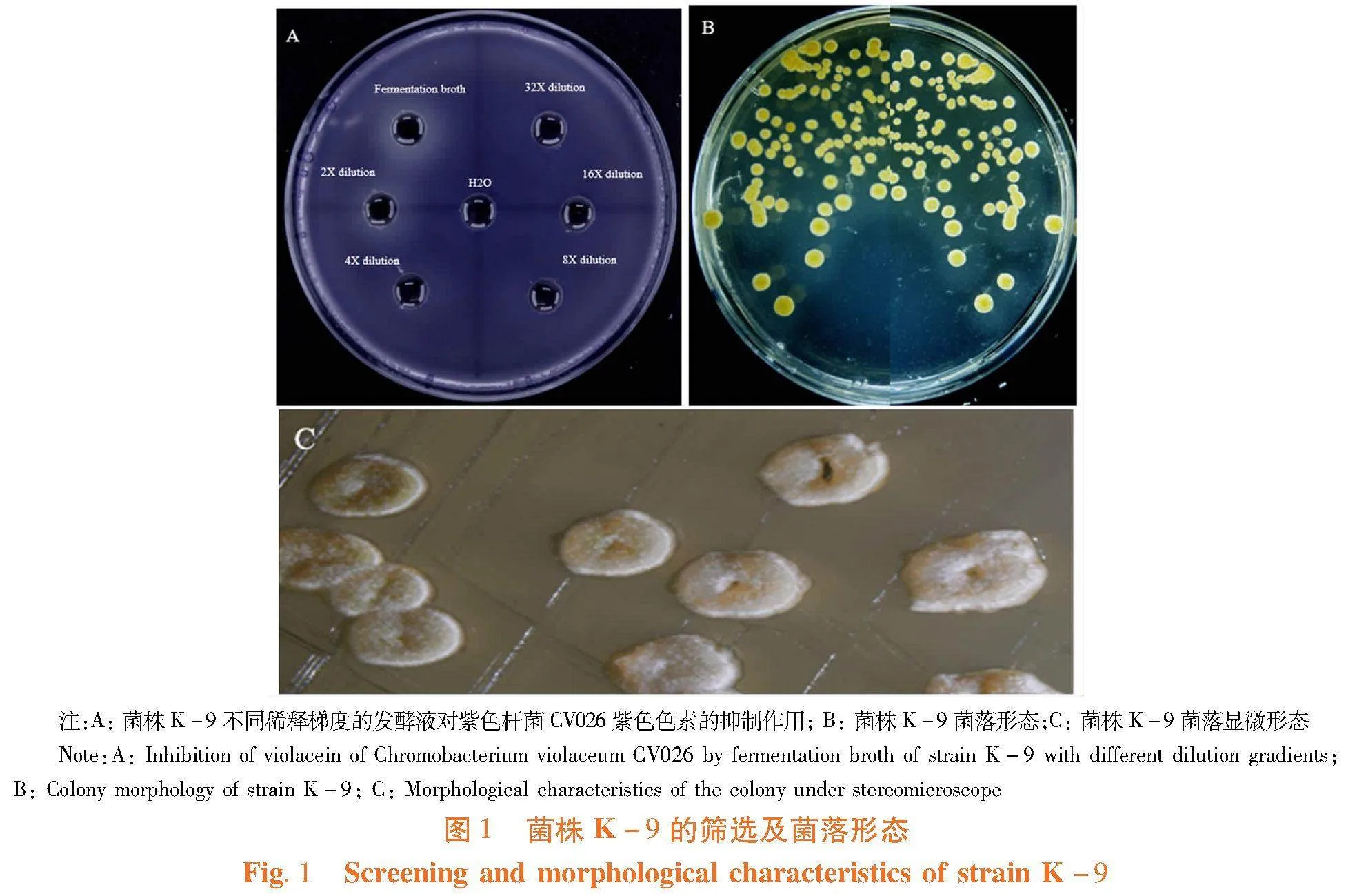
研究表明,与对照无菌水相比,菌株K-9发酵液可产生较大的模糊圈,该菌株发酵液无明显抑制紫色杆菌CV026的生长,但可以明显抑制紫色杆菌CV026产生紫色色素,且经稀释4倍仍具有较淡模糊圈,该菌株具有明显的群体感应抑制效果。
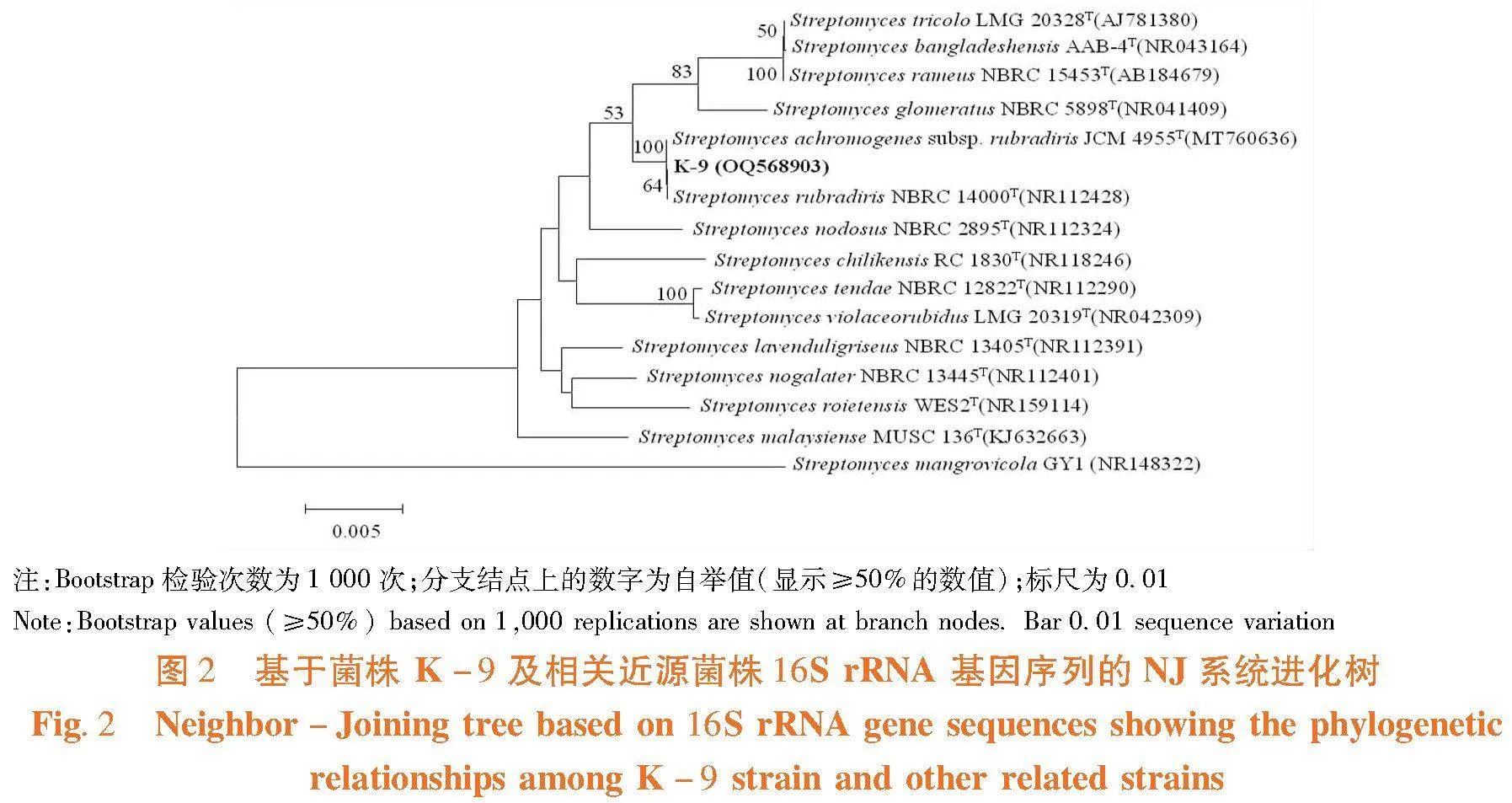
菌株K-9菌落大小为0.2~0.6(cm)×0.2~0.6(cm),其与培养基结合较紧、质地致密,中间凹陷,气生菌丝呈白色绒状,孢子呈白色,基内菌丝呈淡黄色。构建系统发育进化树,菌株K-9隶属于链霉菌属,其16S rRNA基因序列与Streptomyces rubradiris NBRC 14000T相似性达到99.72%,其16S rRNA基因序列登录号为OQ568903。图1,图2
2.2 粗提液群体感应抑制效果验证
2.2.1 粗提液TLC活性成分生物显影
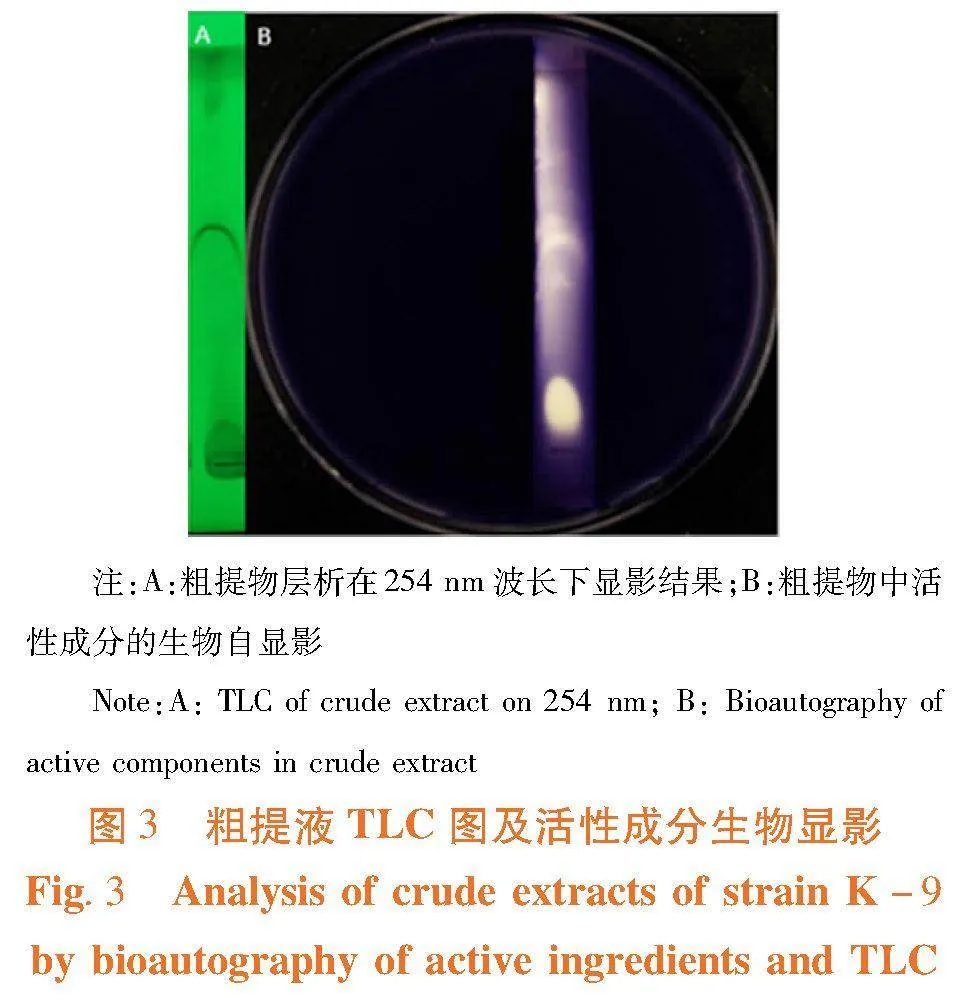
研究表明,100 mg/mL浓度粗提液在254 nm紫外照射下出现三个明显的暗斑,群体感应活性中心条带处具有明显着色条带,其主要活性基团具有254 nm紫外吸收能力。在TLC薄板上方有多处明显菌株生长,但无紫色素积累条带,粗提液中含有较强的群体感应抑制活性。图3
2.2.2 不同浓度粗提液对菌株生长的影响
研究表明,高浓度的粗提液对紫色杆菌和梨火疫病原菌生长均有明显的抑制,但低浓度下对不同菌抑制效果存在不同,当粗提液浓度为2.5 mg/mL时紫色杆菌生长即受明显影响,而梨火疫病原菌在浓度为5 mg/mL仍可微弱生长。表1
2.2.3 对紫色杆菌紫色色素产生的影响
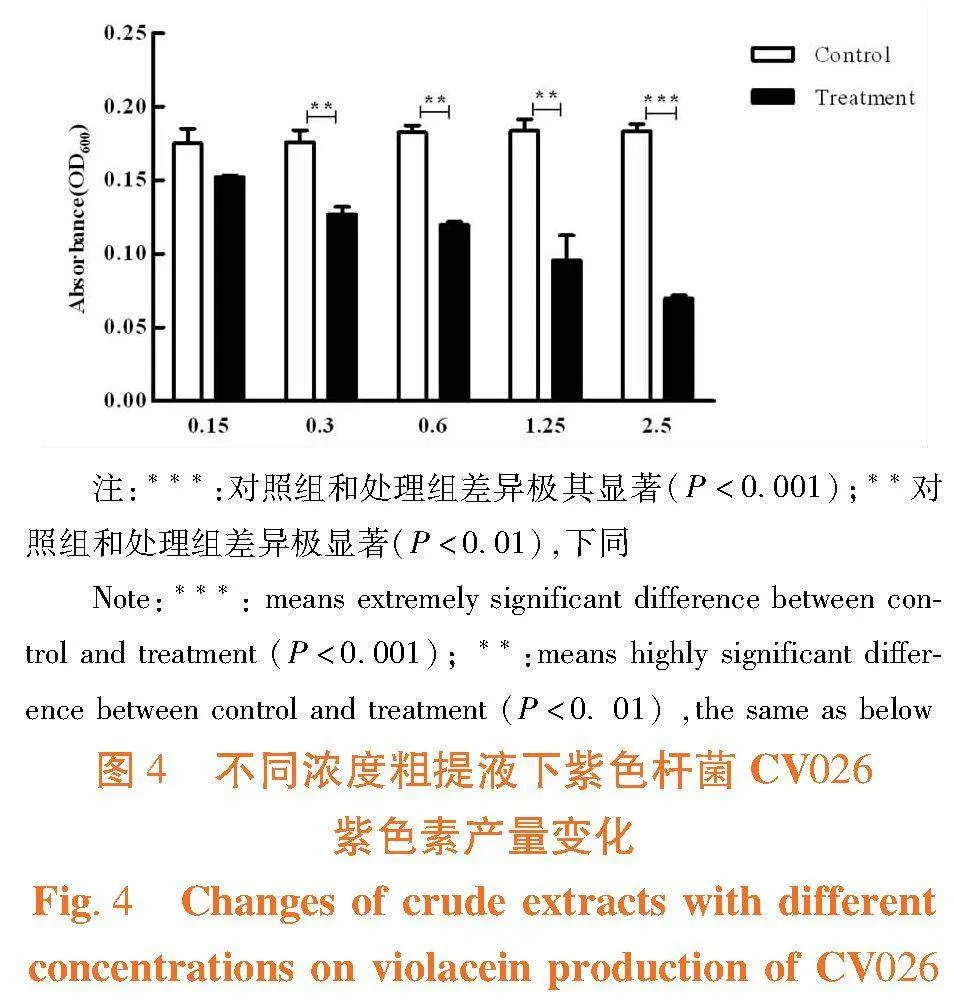
研究表明,各试验组中粗提液均对紫色杆菌CV026紫色色素产量有着明显影响,且随着粗提液浓度的升高,紫色色素含量显著减少。当粗提物浓度为2.5 mg/mL时,对紫色色素产生具有极其显著抑制作用;当粗提液浓度为0.3~1.25 mg/mL时,对紫色色素产生具有极显著抑制作用;即使浓度0.15 mg/mL的粗提液仍能有效降低其紫色素产量,达到12.95%,粗提液具有较强的群体感应抑制剂活性。图4
2.3 粗提液对梨火疫病原菌群体感应抑制效果
2.3.1 粗提液对生物膜产生的影响
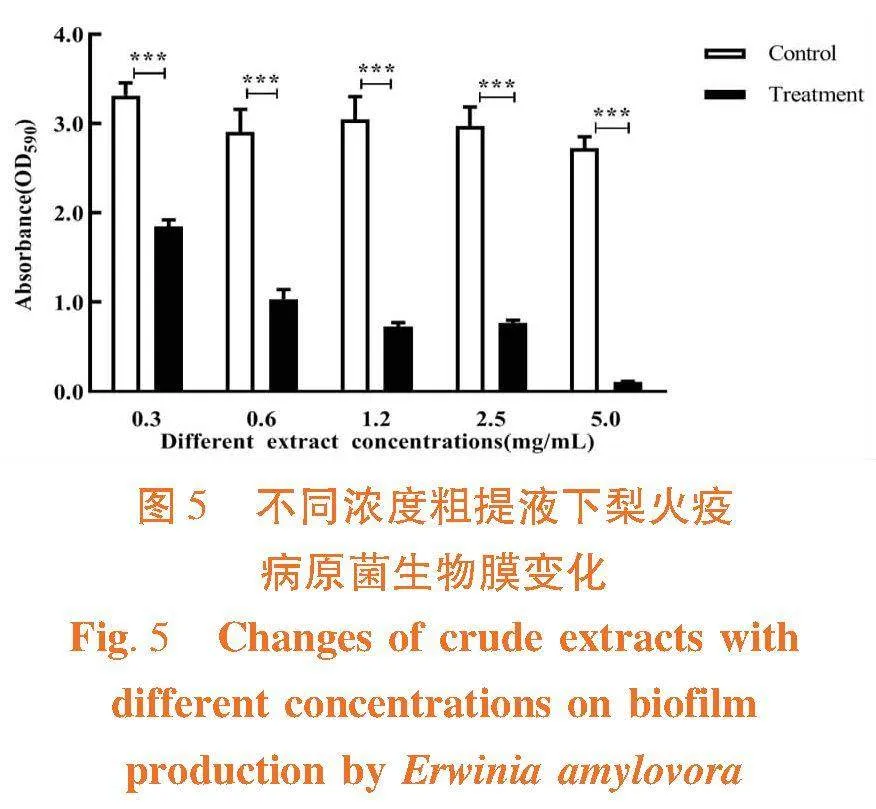
研究表明,各粗提液浓度均对梨火疫病原菌生物膜产生有极其显著的影响,且随着粗提液浓度的升高,生物膜抑制作用也逐渐增强,其中浓度为5 mg/mL时对生物膜有抑制作用最为显著,抑制率达95.92%。图5
2.3.2 粗提液对胞外多糖产量的影响
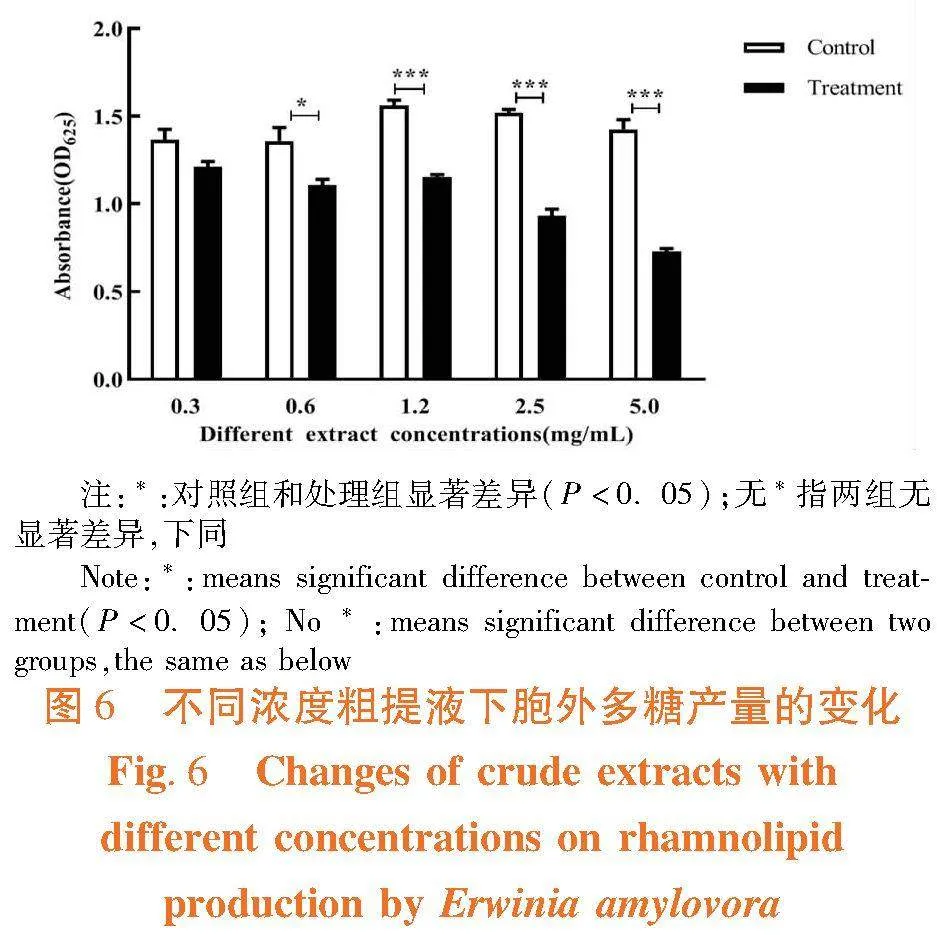
研究表明,不同添加浓度对胞外多糖产量有着不同的影响效果,当粗提物浓度为1.2~5.0 mg/mL时抑制效果最显著,抑制率分别为48.98%、38.62%、26.27%,当浓度低于0.6 mg/mL时抑制效果不显著。图6
2.3.3 粗提液对蛋白酶的影响
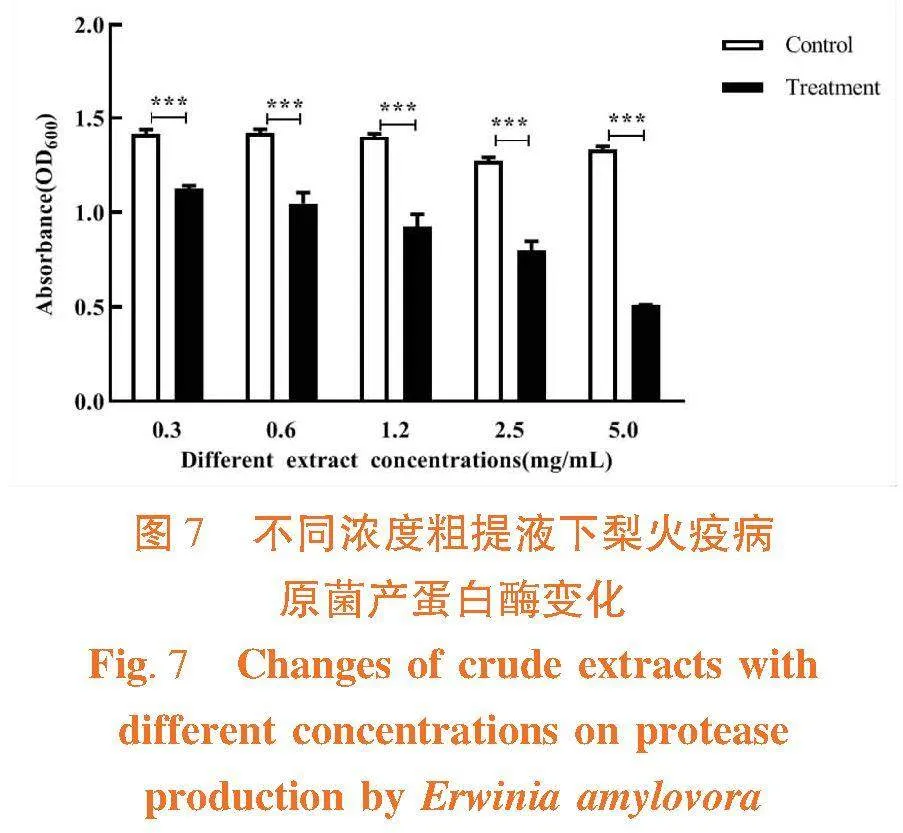
研究表明,在添加浓度为0.3~5 mg/mL时的粗提液时,菌株蛋白酶抑制率呈浓度依赖性下降,均有极其显著抑制作用,抑制率分别为61.8%、37.07%、33.94%、26.34%和20.23%。图7
2.3.4 粗提液对菌株群集和泳动性影响
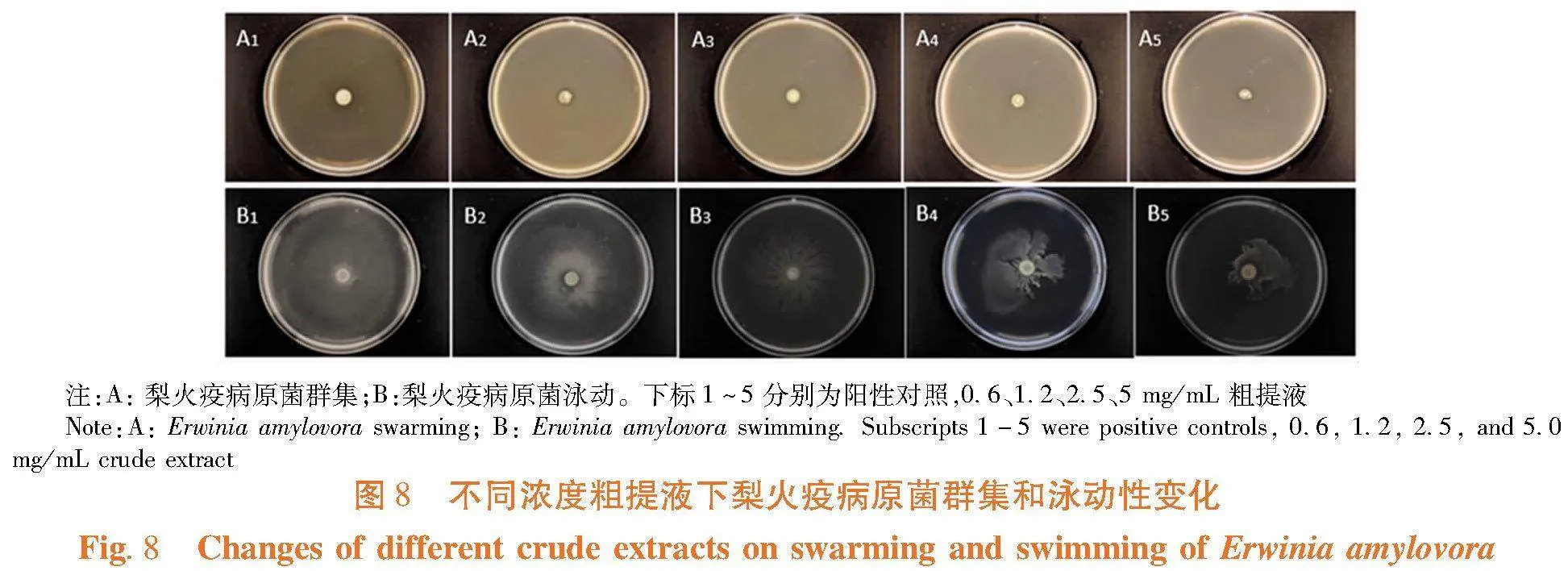
研究表明,梨火疫病原菌群集在有无粗提液处理下均不明显,而加入粗提液后对病原菌泳动性具有明显的抑制,且随着浓度的增加抑制效果更为明显。图8
2.4 粗提液活性物质
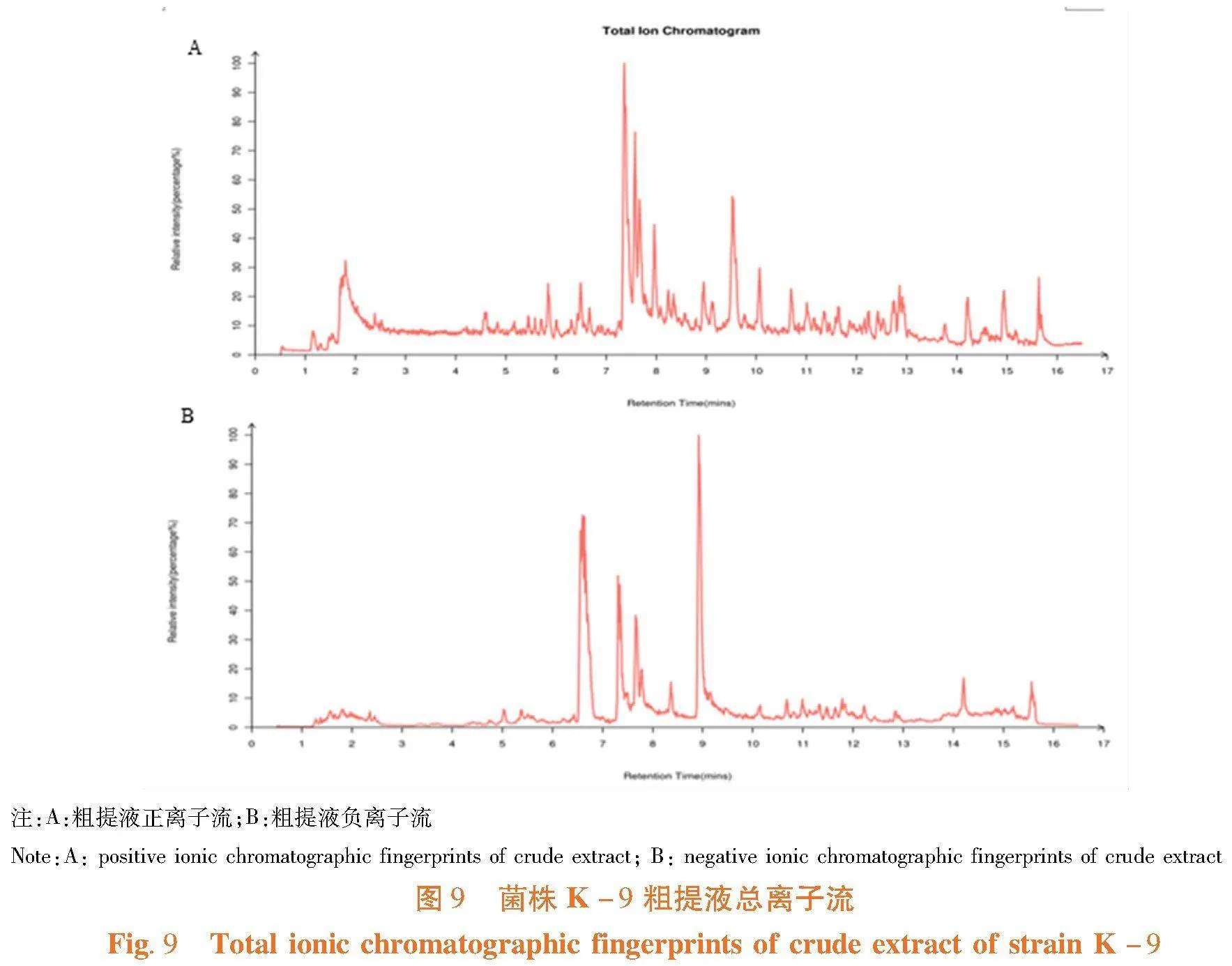
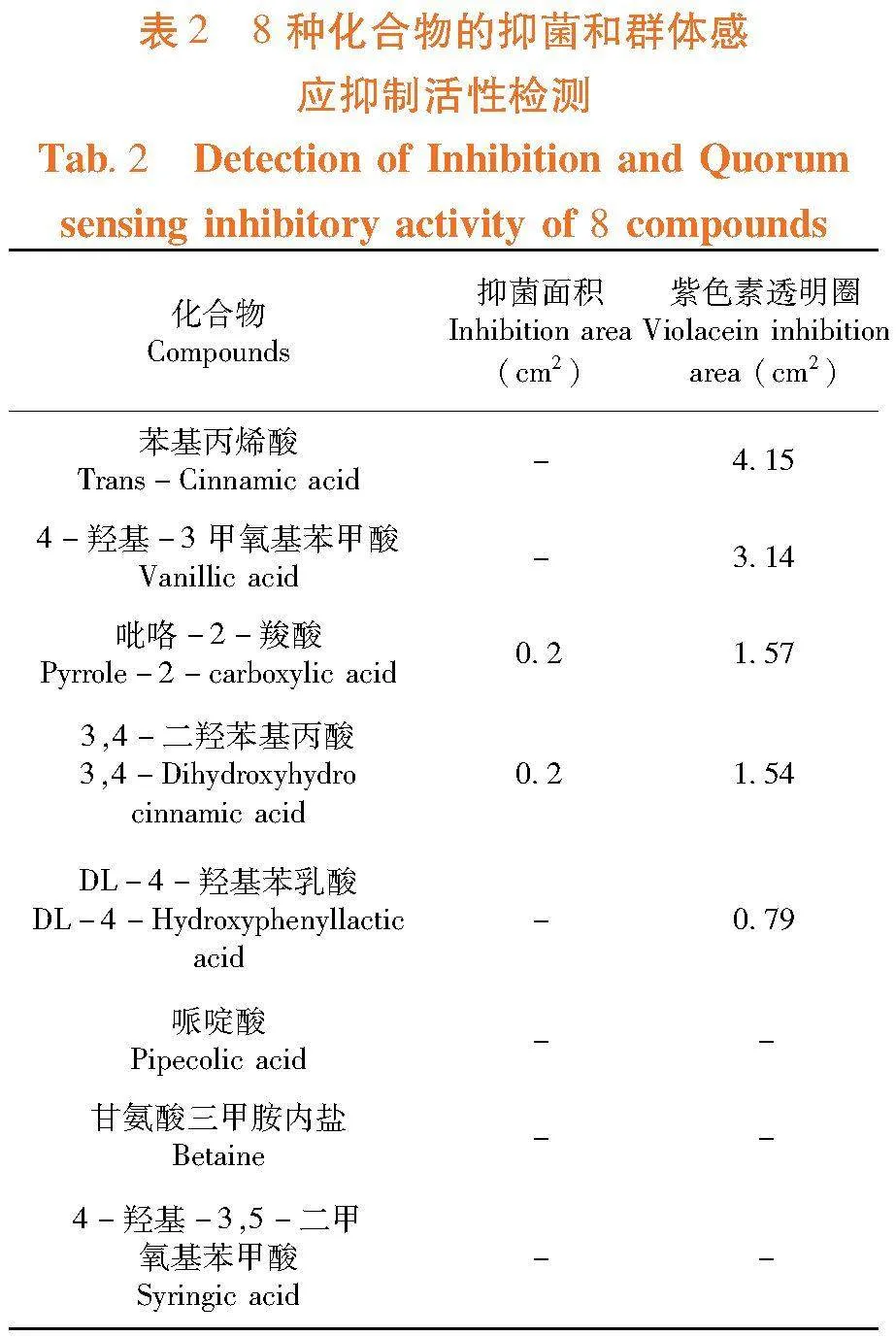
研究表明,鉴定出635种代谢化合物,遴选出8个化合物进行功能验证。在浓度均为10 mg/L时,所选化合物中有5种具有明显群体感应抑制活性,其中2种化合物也具有较为明显的抑菌活性。苯基丙烯酸和4-羟基-3甲氧基苯甲酸的抑制活性最高,群体感应面积分别达4.15和3.14 cm2;吡咯-2-羧酸和3,4-二羟苯基丙酸同时具有抑菌活性和群体感应抑制活性;DL-4-羟基苯乳酸群体感应抑制活性最低,抑制面积为0.79 cm2,其余各化合物没有群体感应抑制活性。图9,表2
3 讨 论
3.1
微生物来源的天然活性产物33 500种,其中放线菌来源的有13 700种,约占41%,而链霉菌属来源的占其80%左右[22]。沙漠极端环境具有极端干旱、强紫外线辐射和昼夜周期极端温度变化等特征,有着丰富的极端环境微生物,其中,放线菌是重要组成部分之一[23]。库木塔格沙漠夏季炎热干燥,最高气温达到49.6 ℃,地表温度最高可达82.5 ℃,而冬季一般气温在-10 ℃左右,极端低温可达-29 ℃,全年偶有雨雪,生态环境极其特殊。该区域放线菌占可培养菌群的绝对优势,并筛选到一株具有明显群体感应抑制活性菌株K-9,其16S rRNA基因序列与Streptomyces rubradiris NBRC 14000T相似性达到99.72%。
3.2
群体感应抑制剂来源多种多样,包括动物、植物以及微生物,其中,多种放线菌被报道代谢产物具有群体感应抑制活性,如灰红肉链霉菌、达松维尔拟诺卡氏菌、微小链霉菌、杀黄胞链霉菌等[10,24]。Hassan等[25]从土壤样品中分离出Streptomyces coelicoflavus,其代谢产物1H-吡咯-2-羧酸可以抑制群体感应相关基因的表达;Ooka等[26]从土壤中分离出Streptomyces phaeofaciens其多种代谢产物菜青素A1 、3-鼠李糖苷A1以及新化合物菜青素E具有群体感应抑制活性;周恒等[24]和Ishaque等[27]分别从中国连云港海区表层海水和印度南部罗美斯瓦伦海岸土壤中分离到Streptomyces parvulus和Streptomyces tendae具有群体感应抑制活性;Velasco-Bucheli等[28]分离出的Streptomyces lavendulae代谢产物青霉素酰化酶可有效水解几种AHL的酰胺键。试验获得菌株Streptomyces sp. K-9与已报道的Streptomyces coelicoflavus、Streptomyces tendae 和Streptomyces griseoincarnatus[29]均具有较近的相似性,分别为98.37%、98.72%和98.58%,预示着Streptomyces sp. K-9可能有着三株菌相似的群体感应抑制活性产物或代谢途径,相关研究有待深入。
3.3
Molina等[30]将信号分子内酯酶基因导入荧光假单胞菌可降低胡萝卜软腐病的症状;在大肠杆菌中异种表达的aim基因产物也对群体感应信号分子具有较强的水解活性,可减少马铃薯软腐病欧文氏菌产生果胶酶活性从而减轻软腐病侵害[31];Kang等[10]发现Streptomyces xanthocidicus KPP01532代谢产物piericidin A和glucopiericidin A可以抑制马铃薯软腐病欧文氏菌(Erwinia carotovora subsp. atroseptica)毒力基因表达。试验对Streptomyces sp.K-9代谢粗提物进行分析,发现其对紫色杆菌CV026具有较强的群体感应抑制活性,且能明显抑制梨火疫病原菌泳动特性,对菌株的生物膜、胞外多糖、蛋白酶产生具有显著抑制活性,并呈明显的浓度依赖性,在试验条件下相关最高抑制率分别可达95.92%、48.98%和61.8%。同时,高浓度K-9粗提液具有明显的抑菌活性,该菌的发酵液可通过群体感应抑制和抑菌活性联合对有害菌株生长进行抑制。
3.4
5种具有群体感应抑制化合物,除发现了苯基丙烯酸和4-羟基-3甲氧基苯甲酸[32, 33]已报道外,发现吡咯-2-羧酸和3,4-二羟苯基丙酸同时还具有较为明显的抑菌活性,而3,4-二羟苯基丙酸、DL-4-羟基苯乳酸此前未见报道,显示链霉菌K-9丰富的群体感应抑制活性化合物代谢能力,相关化合物的进一步功能评价及发酵代谢优化,有待深入开展。
4 结 论
从新疆库木塔格沙漠分离出一株群体感应抑制活性放线菌K-9,经16S rRNA基因序列分子鉴定其于Streptomyces rubradiris NBRC 14000T相似性达到99.72%。发酵粗提液在亚抑菌浓度下能明显抑制紫色杆菌紫色色素的产生,且能显著抑制梨火疫病原菌的泳动性,对其生物膜、胞外多糖、蛋白酶等毒力因子代谢的抑制率最高可达95.92%、48.98%和61.8%。从链霉菌K-9粗提液鉴定出635个化合物,筛选出5种具有明显的群体感应抑制活性。
参考文献(References)
[1]Kalia V C. Quorum sensing inhibitors: an overview[J]. Biotechnology Advances, 2013, 31(2): 224-245.
[2] Papenfort K, Bassler B L. Quorum sensing signal-response systems in Gram-negative bacteria[J]. Nature Reviews Microbiology, 2016, 14(9): 576-588.
[3] Liu L, Yan Y, Feng L, et al. Quorum sensing asaI mutants affect spoilage phenotypes, motility, and biofilm formation in a marine fish isolate of Aeromonas salmonicida[J]. Food Microbiology, 2018, 76: 40-51.
[4] 周静煌, 严准, 高春生, 等. 群体感应抑制及其植物病害防控应用研究进展[J]. 南方农业学报, 2017, 48(12): 2197-2203.ZHOU Jinghuang, YAN Zhun, GAO Chunsheng, et al. Quorum sensing inhibition and its application in plant disease control: a review[J]. Journal of Southern Agriculture, 2017, 48(12): 2197-2203.
[5] Defoirdt T. Quorum-sensing systems as targets for antivirulence therapy[J]. Trends in Microbiology, 2018, 26(4): 313-328.
[6] 鲁晏宏, 郝金辉, 罗明, 等. 梨火疫病拮抗菌筛选及温室防效测定[J]. 微生物学通报, 2021, 48(10): 3690-3699.LU Yanhong, HAO Jinhui, LUO Ming, et al. Screening of antagonistic bacteria against Erwinia amylovora and its control effect in greenhouse[J]. Microbiology China, 2021, 48(10): 3690-3699.
[7] 李雅华, 咸洪泉, 李树文, 等. 拮抗胡萝卜软腐欧文氏杆菌的放线菌的分离和筛选[J]. 青岛农业大学学报(自然科学版), 2009, 26(2): 143-146.LI Yahua, XIAN Hongquan, LI Shuwen, et al. Isolating and screening of antagonistic Actinomyces to erwonia carotovora var. carotovora[J]. Journal of Qingdao Agricultural University (Natural Science), 2009, 26(2): 143-146.
[8] Barnard A M L, Salmond G P C. Quorum sensing in Erwinia species[J]. Analytical and Bioanalytical Chemistry, 2007, 387(2): 415-423.
[9] 高岩. 梨火疫病菌群体感应系统的初步研究[D]. 南京: 南京农业大学, 2006.GAO Yan. A Primary Study of Quorum Sensing in Erwinia Amylovora[D]. Nanjing: Nanjing Agricultural University, 2006.
[10] Kang J E, Han J W, Jeon B J, et al. Efficacies of quorum sensing inhibitors, piericidin A and glucopiericidin A, produced by Streptomyces xanthocidicus KPP01532 for the control of potato soft rot caused by Erwinia carotovora subsp. atroseptica[J]. Microbiological Research, 2016, 184: 32-41.
[11] Dong Y H, Wang L H, Xu J L, et al. Quenching quorum-sensing-dependent bacterial infection by an N-acyl homoserine lactonase[J]. Nature, 2001, 411(6839): 813-817.
[12] Abdulla Y, Al-Mahdi, Saeed M, et al. Isolation and Identification of Bioactive Actinomycete Isolates from Yemen Soils[J]. Thamar University Journal of Natural amp; Applied Sciences, 2020, 4(2073-0764): 113-123.
[13] Rehman Z U, Leiknes T. Quorum-quenching bacteria isolated from red sea sediments reduce biofilm formation by Pseudomonas aeruginosa[J]. Frontiers in Microbiology, 2018, 9: 1354.
[14] Martinelli D, Grossmann G, Séquin U, et al. Effects of natural and chemically synthesized furanones on quorum sensing in Chromobacterium violaceum[J]. BMC Microbiology, 2004, 4: 25.
[15] 丁晓艳, 赵英博, 王伟杰, 等. 薄层色谱-生物自显影技术在活性物质筛选中的应用[J]. 实用药物与临床, 2017, 20(10): 1220-1224.DING Xiaoyan, ZHAO Yingbo, WANG Weijie, et al. Application of TLC-bioautography in active components screening[J]. Practical Pharmacy and Clinical Remedies, 2017, 20(10): 1220-1224.
[16] Choo J H, Rukayadi Y, Hwang J K. Inhibition of bacterial quorum sensing by vanilla extract[J]. Letters in Applied Microbiology, 2006, 42(6): 637-641.
[17] Zhang J, Rui X, Wang L, et al. Polyphenolic extract from Rosa rugosa tea inhibits bacterial quorum sensing and biofilm formation[J]. Food Control, 2014, 42: 125-131.
[18] 于福浩, 娄在祥, 王洪新, 等. 咖啡酸对铜绿假单胞菌群体感应的抑制及毒力因子降低的研究[J]. 食品与生物技术学报, 2019, 38(6): 56-63.YU Fuhao, LOU Zaixiang, WANG Hongxin, et al. Effect of caffeic acid on quorum sensing and virulence factors of Pseudomonas aeruginosa[J]. Journal of Food Science and Biotechnology, 2019, 38(6): 56-63.
[19] 刘佳宜, 李婷婷, 励建荣, 等. 乙基麦芽酚对杀鲑气单胞菌群体感应及腐败活性的抑制作用[J]. 食品科学, 2021, 42(17): 27-33.LIU Jiayi, LI Tingting, LI Jianrong, et al. Inhibitory effect of ethyl maltol on quorum sensing and spoilage capacity of Aeromonas salmonicida[J]. Food Science, 2021, 42(17): 27-33.
[20] Zelena E, Dunn W B, Broadhurst D, et al. Development of a robust and repeatable UPLC-MS method for the long-term metabolomic study of human serum[J]. Analytical Chemistry, 2009, 81(4): 1357-1364.
[21] Want E J, Masson P, Michopoulos F, et al. Global metabolic profiling of animal and human tissues via UPLC-MS[J]. Nature Protocols, 2013, 8(1): 17-32.
[22] Nouioui I, Carro L, García-López M, et al. Genome-based taxonomic classification of the Phylum Actinobacteria[J]. Frontiers in Microbiology, 2018, 9: 2007.
[23] Sun Y, Shi Y L, Wang H, et al. Diversity of bacteria and the characteristics of Actinobacteria community structure in badain jaran desert and tengger desert of China[J]. Frontiers in Microbiology, 2018, 9: 1068.
[24] 周恒, 姜芸, 许叶祥, 等. 一株海洋微小链霉菌群体感应抑制活性及培养条件的研究[J]. 生物技术通报, 2019, 35(10): 137-143.ZHOU Heng, JIANG Yun, XU Yexiang, et al. Research on quorum sensing inhibitory activity and culture condition of a marine Streptomyces parvulus[J]. Biotechnology Bulletin, 2019, 35(10): 137-143.
[25] Hassan R, Shaaban M I, Abdel Bar F M, et al. Quorum sensing inhibiting activity of Streptomyces coelicoflavus isolated from soil[J]. Frontiers in Microbiology, 2016, 7: 659.
[26] Ooka K, Fukumoto A, Yamanaka T, et al. Piericidins, novel quorum-sensing inhibitors against Chromobacterium violaceum CV026, from Streptomyces sp. TOHO-Y209 and TOHO-O348[J]. Open Journal of Medicinal Chemistry, 2013, 3(4): 93-99.
[27] Ishaque N M, Burgsdorf I, Limlingan Malit J J, et al. Isolation, genomic and metabolomic characterization of Streptomyces tendae VITAKN with quorum sensing inhibitory activity from southern India[J]. Microorganisms, 2020, 8(1): 121.
[28] Velasco-Bucheli R, Hormigo D, Fernández-Lucas J, et al. Penicillin acylase from Streptomyces lavendulae and aculeacin A acylase from Actinoplanes utahensis: two versatile enzymes as useful tools for quorum quenching processes[J]. Catalysts, 2020, 10(7): 730.
[29] Kamarudheen N, Rao K V B. Fatty acyl compounds from marine Streptomyces griseoincarnatus strain HK12 against two major bio-film forming nosocomial pathogens; an in vitro and in silico approach[J]. Microbial Pathogenesis, 2019, 127: 121-130.
[30] Molina L, Constantinescu F, Michel L, et al. Degradation of pathogen quorum-sensing molecules by soil bacteria: a preventive and curative biological control mechanism[J]. FEMS Microbiology Ecology, 2003, 45(1): 71-81.
[31] Wang W Z, Morohoshi T, Ikenoya M, et al. AiiM, a novel class of N-acylhomoserine lactonase from the leaf-associated bacterium Microbacterium testaceum[J]. Applied and Environmental Microbiology, 2010, 76(8): 2524-2530.
[32] 曾芝瑞. 从中药中虚拟筛选和鉴定细菌群体感应抑制剂[D]. 广州: 中山大学, 2009.ZENG Zhirui. Virtual screening and identification of bacterial quorum sensing inhibitors from traditional Chinese medicine[D].Guangzhou: Sun Yat-sen University, 2009.
[33] 曾利, 蔡杨, 凌保东. 中药单体对细菌群体感应系统的影响[J]. 中国药理学与毒理学杂志, 2021, 35(10): 754.ZENG Li, CAI Yang, LING Baodong. Effect of traditional Chinese medicine monomer on bacterial quorum sensing system[J]. Chinese Journal of Pharmacology and Toxicology, 2021, 35(10): 754.

