
摘 要:【目的】研究低温与水分胁迫条件下萎锈灵对棉花种子发芽和幼苗形态建成的影响。
【方法】以萎锈灵包衣棉种为材料,利用人工气候箱结合盆栽沙土持水量控制模拟田间低温和水分环境,分析萎锈灵对棉花种子萌发指标、幼苗形态指标和生理生化特性的影响。
【结果】与常温条件相比,低温胁迫处理降低棉花种子的发芽率,降低21.95%;与低温胁迫相比,萎锈灵处理增加棉花种子的发芽率,增加14.06%;与正常水分条件相比,干旱胁迫处理降低棉花种子发芽率,降低29.41%;与干旱胁迫相比,萎锈灵处理增加棉花种子的发芽率,增加11.67%。低温使棉苗的株高、根长显著减小,棉苗地上部的生物量积累减少。在低温水分共同处理下,未包衣处理的丙二醛含量和细胞膜相对透性增大,而萎锈灵包衣棉苗最高分别降低14.71%和24.14%。水分胁迫下渗透调节物质以可溶性糖为主,低温下以可溶性蛋白为主,萎锈灵包衣棉苗低温水分共同处理下两者含量均最高,分别为15.56%和20.14%。低温水分胁迫条件下,萎锈灵包衣棉苗抗氧化酶活性均最大,抗氧化酶相关基因的表达也更高。
【结论】低温和水分胁迫抑制了棉花萌发和生长,导致叶片的氧化伤害。棉苗启动了活性氧清除机制来抵抗氧化损伤。萎锈灵能够通过改变渗透调节物质含量,增强抗氧化酶活性,抑制膜质过氧化,从而增强棉苗的抗低温和干旱迫能力。
关键词:萎锈灵;温度;持水量;种子萌发;生理指标
中图分类号:S435.62"" 文献标志码:A"" 文章编号:1001-4330(2024)12-3051-10
0 引 言
【研究意义】近年来极端天气频发,低温寒潮等气象灾害增多,对农业生产影响较大[1]。棉花属典型的冷敏感性作物,在新疆北疆棉区棉花播种季节中也经常遭遇“倒春寒”等低温气象灾害,致使土壤温度墒情不够,致使棉种发芽出苗时间推迟,甚至造成不同程度的烂种、烂芽、死苗现象发生。因此,低温与水分胁迫条件下研究萎锈灵对棉花种子发芽和幼苗形态的影响,为棉花科学防灾减损提供新途径。【前人研究进展】棉花原产于热带,是典型的喜温作物,表现出对土壤温度湿度的敏感性[2]。然而,与其他棉区比较,近年新疆北疆棉区降水呈现增多趋势,春季平均温度9℃,“倒春寒”发生概率高,棉花更易受到低温冷害气象灾害侵袭[3]。2021年新疆“倒春寒”等灾害性天气导致气温骤然降低,致使棉花苗弱迟发,生长发育推迟,对棉花产量和品质产生了不利影响[4]。抗寒剂种衣剂包衣可明显促进低温胁迫下棉花种子萌发,提高其耐冷性[5];18.6%拌·福·乙种衣剂具有抗寒功能的种衣剂能促棉种萌发,提高发芽率,保护棉苗细胞超微结构稳定,维持正常生长,增强幼苗抵御低温的能力[6]。但是,棉花播种期遭遇低温多雨天气严重的年份,土壤温度低湿度高,对棉花种子的发芽、根系和地上部生长不利,仍然难以确保田间较高保苗率。因此,迫切需要研究新技术和新产品来提高棉花的发芽率。【本研究切入点】萎锈灵(Carboxin)是美国Uniroyal公司发现的琥珀酸脱氢酶抑制剂(succinate dehydrogenase inhibitors,SDHI)类杀菌剂,具有优异的内吸性。因SDHI方剂自成体系,其作用于病原菌线粒体内膜上的琥珀酸脱氢酶被国际杀菌剂抗性行动委员会将分为独立的类别[7, 8]。其主要合成工艺流程是以乙酰乙酰苯胺和磺酰氯为原料经过氯代得到氯代物,再与2-巯基乙醇经缩合反应得到缩合物,最后成环缩合得到萎锈灵,具有条件温和、易操作和生产成本较低等优点[9, 10]。萎锈灵具有高效低毒、杀菌广谱性、生长刺激作用和增产效果显著的优点,其作用是通过干扰病原菌呼吸电子传递链上复合体Ⅱ来抑制线粒体的功能,阻止其产生能量,抑制病原菌生长,最终导致其死亡[11, 12]。萎锈灵处理不仅对麦类锈病、散黑穗病以及棉花立枯病等有较好防效,而且能促进棉花生长,增强棉苗耐冷胁迫的能力[13-15]。但是,种衣剂包衣种子播种时对土壤温度和墒情有一定要求,而包衣、温度和水分对棉花种子萌发以及棉苗素质的影响及其互作效应不清楚,迄今鲜有报道。因此,在前期研究萎锈灵处理对低温胁迫下棉种子萌发特性的基础上,进一步研究包衣、温度和水分对棉花种子萌发和和幼苗形态建成的影响及其互作效应。【拟解决的关键问题】以新疆北部棉区主栽棉花品种新陆早50号为研究对象,在室内模拟田间土壤低温和不同水分条件下,将萎锈灵制成悬浮种衣剂包衣棉种,分析水分、温度和包衣对棉种萌发、幼苗农艺性状和生理生化特性的相关指标的影响及其互作效应,为萎锈灵包衣棉种运用于农业生产提供理论依据。
1 材料与方法
1.1 材 料
试验于2022~2023年在新疆农业科学院核技术生物技术研究所进行。供试棉花品种为新疆北部棉区主栽品种新陆早50号,由新疆农业科学院经济作物研究所提供。选择籽粒饱满的种子经1%次氯酸钠消毒10 min,灭菌蒸馏水冲洗干净并晾干,在前期研究基础上采用7.2%的萎锈灵种衣剂按药种质量比1∶100进行包衣后备用。
1.2 方 法
1.2.1 试验设计
采用3因素(土壤水分、萎锈灵包衣和温度)完全随机区组设计。水分处理设置3个水平即模拟田间土壤的含水量以砂床持水量70%~75%为常规对照,55%~60%作为旱胁迫处理,85%~90%作为湿胁迫处理。每种水分处理下设置包衣和未包衣2种包衣处理:光籽和7.2%萎锈灵包衣分别记作C0和CT;每种包衣处理下设置常温和低温两种温度处理:28℃/25℃(昼/夜和16℃/6℃(昼/夜)分别记作T0记作TL,即每种水分处理有未包衣常温(C0+T0)、未包衣低温(C0+TL)、包衣常温(CT+T0)、包衣低温(CT+TL)4个处理,共计12个处理,每个处理3次重复。
1.2.2 种子萌发
采用砂培法进行种子萌发试验。经水洗净的细砂干热灭菌后回温到室温下,添加相应含量的灭菌水混匀,装入在有机发芽盒中构建发芽床。每个发芽盒沙床上等距离摆放不同处理的50粒种子,每个处理重复4次,共计200粒种子;参照肖怀娟等[16]方法置于特定温度的室内人工智能气候箱进行种子萌发,昼/夜(12 h/12 h),光照强度3 000 lx。在试验过程中,加盖保湿,棉花种子历时约7 d完成了发芽,后续快速生长防止发芽盒盖被顶开,采用更高的盒子罩住,以防止土壤水分蒸发,同时采用EL-USB-2型Easy Log温湿度记录仪监测砂床含水量,结合称重法根据监测砂床含水量情况及时以灭菌的蒸馏水补充因蒸发而损失的土壤水分,以保持砂床含水量。
1.2.3 测定指标
萌发指标:试验过程中,从第3 d开始每隔24 h观察记录种子萌发情况,28℃/25℃和16℃/4℃温度下萌发试验中,苗高达4 cm及以上视为正常发芽,计算发芽势、发芽率、发芽指数和活力指数[17, 18]。
形态指标:在发芽期结束,从各处理中均随机选出10株棉苗,测定胚轴长、胚根长、须根数、胚轴粗(贴近根系处茎秆的最大直径),洗净用吸水纸擦干后称鲜重,洗净后,经105℃杀青30 min,80℃烘干至质量恒定后称干重[17]。
生理指标:在发芽期结束,从各处理中均随机选出子叶,采用电导率测定细胞膜相对透性,而丙二醛含量、可溶性糖、可溶性蛋白以及抗氧化酶超氧化物歧化酶(superoxide dismutase,SOD)、过氧化物还原酶(peroxidase,POD)、过氧化氢酶(Catalase,CAT)的酶活性参照按照苏州科铭生物技术有限公司提供的试剂盒说明进行测定生理生化指标。
抗氧化物酶基因的表达:在发芽期结束,从各处理中均随机选出子叶,按照RNA prePure多糖多酚植物总RNA提取试剂盒(TIANGEN,北京)提取总RNA,利用TaKaRa的Prime ScriptTM RT reagent Kitwithg gDNA Eraser试剂盒说明书进行(宝生物,大连)反转录;引物按田又升等[19]的棉花内参基因和抗氧化物酶基因的设计荧光定量引物;qRT-PCR反应体系采用TaKaRa的SYBRPremixExTaq试剂盒,并按2-ΔΔCt方法计算基因的相对表达量。表1
1.3 数据处理
采用Microsoft Excel2010进行数据分析,用GraphPad Prism软件进行作图;采用Duncan多重比较法进行各处理间差异显著性检验;采用多因素方差分析(Multi-ANOVA)评估持水量、包衣、温度及其交互作用对各指标的影响。
2 结果与分析
2.1 萎锈灵对棉种萌发特征的影响
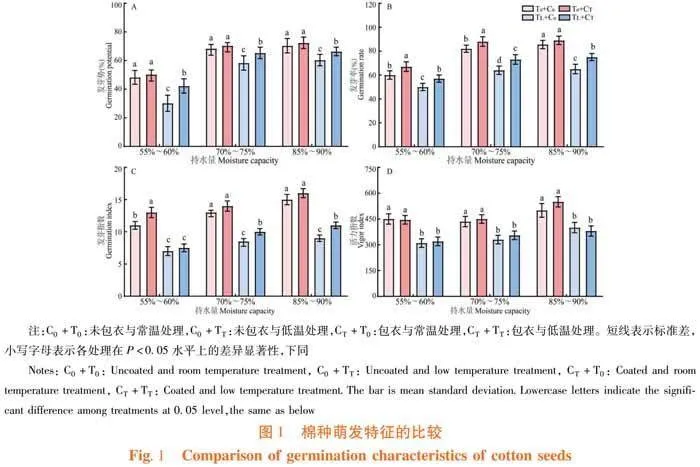
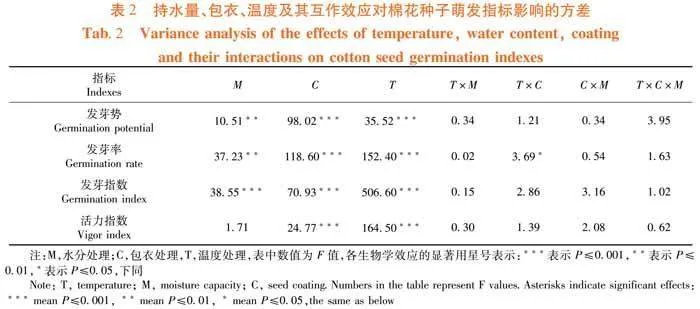
研究表明,与常温条件下相比,低温胁迫处理降低棉花种子的发芽势、发芽率、发芽指数和活力指数,分别降低14.71%、21.95%、34.62%和24.14%,且差异显著。与低温胁迫相比,萎锈灵处理增加棉花种子的发芽势、发芽率、发芽指数和活力指数,分别增加12.07%、14.06%、17.65%和7.58%,且差异显著。与正常水分条件下相比,干旱胁迫处理降低棉花种子的发芽势、发芽率和发芽指数,分别降低29.41%、26.83%和15.38%,且差异显著;高湿胁迫处理降低棉花种子的发芽指数和活力指数,分别降低15.38%和14.94%,且差异显著。与干旱胁迫相比,萎锈灵处理增加棉花种子的发芽率和发芽指数分别增加11.67%和18.18%,且差异显著。与高湿胁迫相比,萎锈灵处理增加棉花种子的发芽指数,增加6.67%,且差异显著。图1
持水量、包衣、温度3个单因素对棉花种子的发芽势、发芽率、发芽指数的影响均达显著或极显著;温度和包衣对棉花种子的发芽率影响有显著交互作用;温度、持水量和包衣对棉花种子萌发指标的影响交互作用不显著。表2
2.2 萎锈灵对棉苗农艺性状的影响
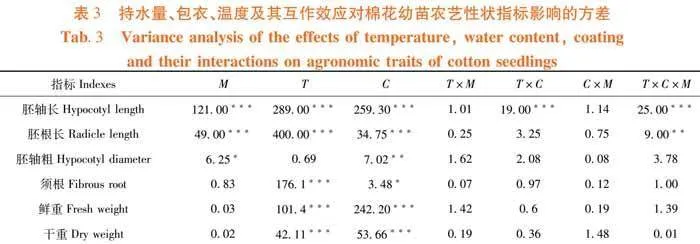
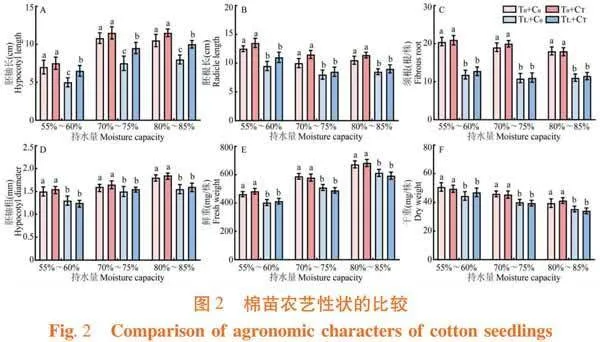
研究表明,在低温和水分胁迫下,萎锈灵处理对棉苗农艺性状的影响不同,不同胁迫条件下幼苗农艺性状表现也略有差异。与常温条件下相比,低温胁迫处理降低棉苗胚轴长、胚根长、须根数、鲜重和干重,分别降低41.67%、27.27%、43.16%、13.42%和12.83%,且差异显著。与低温胁迫相比,萎锈灵处理增加棉苗胚轴长和胚根长,分别增加42.86%和10.71%,且差异显著。与正常水分条件下相比,干旱胁迫处理降低棉苗胚轴长、胚根长、须根数、胚根粗、鲜重和干重,分别降低41.67%、18.18%、7.52%、5.56%、21.39%和10.34%,且差异显著;高湿胁迫处理降低棉苗须根数、胚根粗、鲜重和干重,分别降低5.26%、22.22%、14.26%和14.16%,且差异显著。与干旱胁迫相比,萎锈灵处理增加棉苗胚轴长和胚根粗,分别增加14.29%和11.76%,且差异显著。与高湿胁迫相比,萎锈灵处理增加棉苗胚轴长、胚根长和胚根粗,分别增加8.33%、9.09%和18.18%,且差异显著。图2
持水量、包衣、温度3个单因素对棉花幼苗胚轴长和胚根长的影响均达为显著或极显著;温度和包衣对棉花幼苗的胚轴长影响有极显著的交互作用;温度、持水量和包衣对棉花幼苗的胚轴长和胚根长影响有显著或极显著的交互作用。表3
2.3 萎锈灵对棉苗生理生化特征的影响
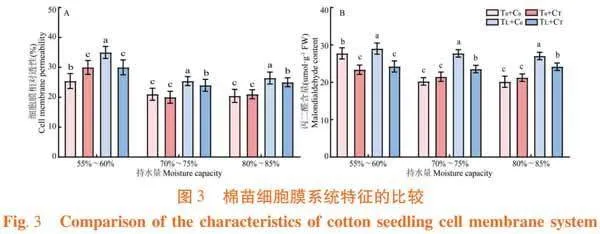
2.3.1 萎锈灵对棉苗幼苗质膜透性的影响
研究表明,与常温条件下相比,低温胁迫处理增加棉苗的细胞膜相对透性和丙二醛含量,分别增加14.71%和24.14%,且差异显著。与低温胁迫相比,萎锈灵处理增加棉苗的细胞膜相对透性和丙二醛含量,分别增加5.71%和6.14%,且差异显著。与正常水分条件下相比,干旱胁迫处理增加棉苗的细胞膜相对透性和丙二醛含量,分别增加14.71%和24.14%,且差异显著。与干旱胁迫相比,萎锈灵处理降低棉苗的细胞膜相对透性,降低14.71%,且差异显著。图3
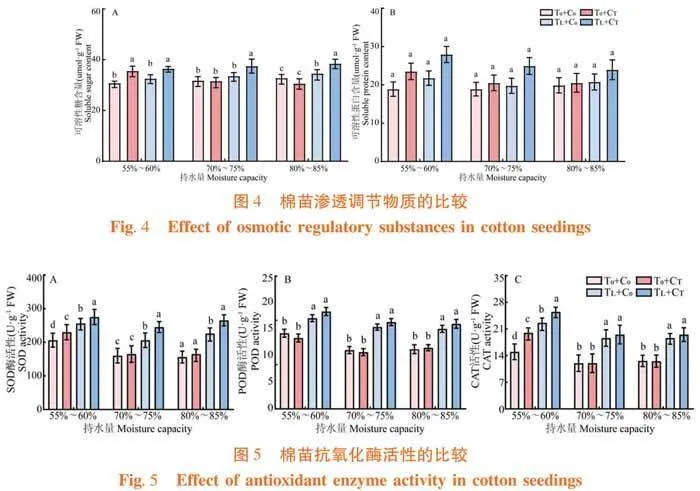
2.3.2 萎锈灵对棉苗渗透调节物质的影响
研究表明,与常温条件下相比,低温胁迫处理增加棉苗的可溶性糖含量,分别增加5.68%,且差异显著。与低温胁迫相比,萎锈灵处理增加棉苗的可溶性糖和可溶性蛋白含量,分别增加11.63%和20.14%,且差异显著。与正常水分条件下相比,高湿胁迫处理增加棉苗的可溶性蛋白含量,分别增加5.29%,且差异显著。与干旱胁迫相比,萎锈灵处理增加棉苗的可溶性糖和可溶性蛋白含量,分别增加15.56%和14.14%,且差异显著。与高湿胁迫相比,萎锈灵处理增加棉苗的可溶性糖含量,增加6.74%,且差异显著。图4
2.3.3 萎锈灵对棉苗抗氧化酶活性的影响
研究表明,与常温条件下相比,低温胁迫处理增加棉苗POD和CAT活性,分别增加25.93%和25.00%,且差异显著。与低温胁迫相比,萎锈灵处理增加棉苗POD活性,增加6.07%,且差异显著。与正常水分条件下相比,干旱胁迫处理增加棉苗POD和CAT活性,分别增加24.93%和23.00%,且差异显著;高湿胁迫处理增加棉苗SOD活性,增加16.64%,且差异显著。与干旱胁迫相比,萎锈灵处理增加棉苗POD和CAT活性,分别增加6.38%和19.22%,且差异显著。与高湿胁迫相比,萎锈灵处理增加棉苗SOD活性,增加11.14%,且差异显著。图5
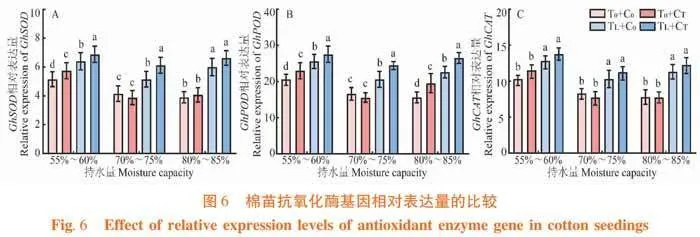
2.4 萎锈灵对棉苗抗氧化酶基因表达量的影响
研究表明,与常温条件下相比,低温胁迫处理增加棉苗SOD、POD和CAT基因表达量,分别增加22.08%、24.08%和23.08%,且差异显著。与低温胁迫相比,萎锈灵处理增加棉苗SOD、POD和CAT基因表达量,分别增加15.94%、16.94%和9.23%,且差异显著。与正常水分条件下相比,干旱胁迫处理增加棉苗SOD、POD和CAT基因表达量,分别增加20.08%、22.08%和23.18%,且差异显著;高湿胁迫处理增加棉苗SOD、POD和CAT基因表达量,分别增加6.02%、6.72%和6.62%,且差异显著。与干旱胁迫相比,萎锈灵处理增加棉苗SOD、POD和CAT基因表达量,分别增加10.58%、11.08%和11.88%,且差异显著。与高湿胁迫相比,萎锈灵处理增加棉苗POD基因表达量,增加22.23%,且差异显著。图6
2.5 持水量、包衣、温度及其互作效应对棉花幼苗生理生化指标的影响
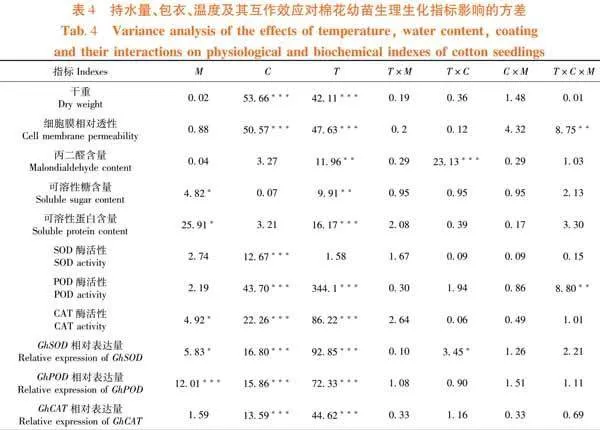
研究表明,持水量、包衣、温度3个单因素对棉花幼苗的CAT酶活性、GhSOD相对表达量、GhPOD相对表达量的影响均达为显著或极显著;温度和包衣对棉花幼苗的丙二醛含、GhSOD相对表达量影响有显著或极显著的交互作用;温度、持水量和包衣对棉花幼苗的细胞膜相对透性、POD酶活性影响有显著的交互作用。表4
3 讨 论
3.1
种子萌发常常要面临多种环境因子共同作用,内因是种子本身的遗传特性等,外因包括温度、土壤水分条件等,外部生态环境起重要的决定作用,其中温度与土壤水分因子的共同作用会加剧对种子发芽和幼苗形态建成的影响。种子包衣可以刺激种子的萌发和生长,并增强种苗的抗逆性[20]。海藻酸钠包衣可以提高玉米的发芽率、发芽指数和活力指数[21]。调节剂包衣可以缓解低温对棉花种子萌发和幼苗生长的抑制作用,从而提高其耐寒性[22]。苯醚甲环唑包衣有助于玉米幼苗补偿和修复低温胁迫导致的伤害[23]。在低温和水分胁迫条件下,萎锈灵包衣后的种子萌发活性明显提高,从而提高了种子的发芽率,这与前人研究结果一致[13, 24]。萎锈灵可以促进种子内营养物质的转化与合成,参与调节植物的代谢水平,激活棉种活力,从而促进棉花的萌发和生长,增强棉苗对低温等逆境环境的适应性和抗逆性。此外,在实际生产中,除了温度和湿度,包衣、光照、土壤条件、盐渍化程度等外部生态环境因素也对种子的萌发产生重要影响。
3.2
幼苗期是植物生长周期中非常关键的阶段,也是对逆境胁迫最敏感的时期。逆境胁迫不仅会增加细胞内活性氧水平,还会诱发植物建立防御体系,以避免或减轻活性氧对植物的损害。已有研究表明,植物膜系统是植物在低温胁迫下最敏感的部位,在低温环境下,植物细胞膜会遭受破坏,导致膜透性增加,细胞内的电解质外渗,从而增加细胞电导率[25]。同时,活性氧的生成和清除平衡被打破,在叶片中会发生膜脂过氧化反应,导致丙二醛含量增加[26]。在低温和土壤水分胁迫条件下,使用萎锈灵处理棉苗的叶片,能够显著降低细胞内的相对电导率和增加丙二醛含量,同时增加可溶性蛋白和可溶性糖的含量,以及抗氧化酶超氧化物歧化酶、过氧化物酶和过氧化氢酶的活性,与田又升等[18]和郑子漂等[26]研究的结果相似。此外,抗氧化酶相关基因的表达也更高。由此表明,在低温和水分胁迫条件下,萎锈灵可以诱导棉苗细胞内的抗氧化酶相关基因表达,从而调节植物的新陈代谢,提高抗氧化酶的活性,以维持细胞中较低水平的活性氧和丙二醛含量,降低细胞膜的渗透性和膜脂过氧化程度,增强抗氧化防御系统的能力。同时,通过增加可溶性糖等渗透调节物质的含量,改变细胞渗透势,降低膜的渗透性,保护细胞膜的结构和功能,有助于缓解逆境胁迫对棉苗的损伤,促进幼苗的生长,增强其对低温等逆境环境的适应能力和抗逆性。然而,外源物质诱导棉苗提高抗逆境胁迫能力是多种性状的综合表现,受到多种生理生化过程和基因表达水平的综合调控。因此,关于保护棉苗免受逆境伤害的机制仍需要进一步深入研究。
4 结 论
在低温和水分胁迫条件下,萎锈灵处理能够促进种子内营养物质的转化与合成,参与调控植物的代谢水平,激活棉种活力,从而提高种子的发芽率。同时,萎锈灵还能够诱导棉苗细胞内部抗氧化酶相关基因的表达,增加抗氧化酶的活性,调节植物的新陈代谢,并清除细胞内产生过多的自由基,减少丙二醛的积累。此外,萎锈灵还能够调节可溶性蛋白、可溶性糖等渗透调节物质的含量,改变细胞的渗透势,降低细胞质膜的透性,保护细胞膜的结构和功能。萎锈灵能够缓解甚至消除逆境胁迫对棉苗的伤害,促进幼苗的生长,增强棉花对低温和干旱等逆境环境的适应性和抗逆性。
参考文献(References)
[1]Li W, Zhao S S, Chen Y, et al. State of Chinas climate in 2020[J]. Atmospheric and Oceanic Science Letters, 2021, 14(4): 100048.
[2] 徐敏, 李憬霖, 叶福民, 等. 温湿度对棉花种子萌发的影响研究[J]. 农学学报, 2022, 12(10): 10-14, 20.
XU Min, LI Jinglin, YE Fumin, et al. Effects of temperature and humidity on cotton seed germination[J]. Journal of Agriculture, 2022, 12(10): 10-14, 20.
[3] 叶尔克江·霍依哈孜, 阿吉古丽·沙依提, 买买提艾力·买买提依明, 等. 新疆气温季节变化时空分布特征研究[J]. 湖北农业科学, 2022, 61(15): 25-33, 41.
Yeerkejiang Huoyihazi, Ajiguli Shayiti, Maimaitiaili Maimaitiyiming, et al. Study on temporal and spatial distribution characteristics of seasonal variation of air temperature in Xinjiang[J]. Hubei Agricultural Sciences, 2022, 61(15): 25-33, 41.
[4] 李茂春, 练文明, 毛树春, 等. 2021年春季气候变化对新疆棉花生长影响及中期管理建议——以阿拉尔垦区为例[J]. 中国棉花, 2021, 48(6): 45-46.
LI Maochun, LIAN Wenming, MAO Shuchun, et al. Effect of climate change in spring of 2021 on cotton growth in Xinjiang and medium term management suggestions: based on the Aral reclamation area[J]. China Cotton, 2021, 48(6): 45-46.
[5] 韩松, 吉庆勋, 杨曼利, 等. 添加抗寒剂对包衣棉花种子萌芽及其耐冷性的影响[J]. 江苏农业科学, 2019, 47(4): 78-81.
HAN Song, JI Qingxun, YANG Manli, et al. Effects of cold-resistant agent on germination and chilling tolerance of coated cotton seeds under low temperature stress[J]. Jiangsu Agricultural Sciences, 2019, 47(4): 78-81.
[6] 雷斌, 李进, 段留生, 等. 种衣剂对低温处理下棉花胚根及幼苗外部形态和超微结构的影响[J]. 中国农业气象, 2017, 38(4): 248-256.
LEI Bin, LI Jin, DUAN Liusheng, et al. Effect of seed coating agents on external morphology and ultrastructure of cotton radicles and seedlings under low temperature treatments[J]. Chinese Journal of Agrometeorology, 2017, 38(4): 248-256.
[7] 毛玉帅, 段亚冰, 周明国. 琥珀酸脱氢酶抑制剂类杀菌剂抗性研究进展[J]. 农药学学报, 2022, 24(5): 937-948.
MAO Yushuai, DUAN Yabing, ZHOU Mingguo. Research progress of the resistance to succinate dehydrogenase inhibitors[J]. Chinese Journal of Pesticide Science, 2022, 24(5): 937-948.
[8] 彭军. 萎锈灵的合成研究[J]. 山东化工, 2021, 50(8): 27-28, 31.
PENG Jun. Study on the synthesis of carboxin[J]. Shandong Chemical Industry, 2021, 50(8): 27-28, 31.
[9] Lee W S, Hahn H G, Nam K D. Synthesis of dihydro-1, 4-oxathiins by rearrangement of 1, 3-oxathiolane sulfoxides[J]. The Journal of Organic Chemistry, 1986, 51(14): 2789-2795.
[10] Cecchini G, Schrder I, Gunsalus R P, et al. Succinate dehydrogenase and fumarate reductase from Escherichia coli[J]. Biochimica et Biophysica Acta, 2002, 1553(1/2): 140-157.
[11] 徐永哲, 上官小来, 岑江杰, 等. 萎锈灵原药的毒性研究[J]. 浙江化工, 2004, 35(12): 11-12.
XU Yongzhe, SHANGGUAN Xiaolai, CEN Jiangjie, et al. Study on the toxicity of carboxin[J]. Zhejiang Chemical Industry, 2004, 35(12): 11-12.
[12] 周小云, 刘梦丽, 李进, 等. 萎锈灵包衣对低温胁迫下棉种萌发特性的影响[J]. 中国农业气象, 2020, 41(8): 495-505.
ZHOU Xiaoyun, LIU Mengli, LI Jin, et al. Effects of the carboxin from seed coating formulation on the cotton seed germination characteristics under low temperature stress[J]. Chinese Journal of Agrometeorology, 2020, 41(8): 495-505.
[13] 周小云, 李进, 张军高, 等. 萎锈灵杀菌剂对提高棉花耐低温冷害胁迫能力的影响[J]. 新疆农业科学, 2020, 57(4): 705-712.
ZHOU Xiaoyun, LI Jin, ZHANG Jungao, et al. Effects of the carboxin fungicide on the chilling stress of cotton seedlings[J]. Xinjiang Agricultural Sciences, 2020, 57(4): 705-712.
[14] Al-Beldawi A S, Jawad A, Sheik-Raddy H M. Rhizoctonia seedling disease of hemp and its control[J]. Crop Protection, 1982, 1(1): 111-113.
[15] 肖怀娟, 李娟起, 王吉庆, 等. 亚低温与干旱胁迫对番茄植株水分传输和形态解剖结构的影响[J]. 应用生态学报, 2020, 31(8): 2630-2636.
XIAO Huaijuan, LI Juanqi, WANG Jiqing, et al. Effects of sub-low temperature and drought stress on water transport and morphological anatomy of tomato plant[J]. Chinese Journal of Applied Ecology, 2020, 31(8): 2630-2636.
[16] 高荣岐, 张春庆. 种子生物学[M]. 北京: 中国农业出版社, 2009.
GAO Rongqi, ZHANG Chunqing. Seed biology[M]. Beijing: China Agriculture Press, 2009.
[17] Shen Q, Zhang S P, Liu S D, et al. Comparative transcriptome analysis provides insights into the seed germination in cotton in response to chilling stress[J]. International Journal of Molecular Sciences, 2020, 21(6): 2067.
[18] 田又升, 王志军, 于航, 等. 干旱胁迫对不同抗旱性棉花品种抗氧化酶活性及基因表达的影响[J]. 西北植物学报, 2015, 35(12): 2483-2490.
TIAN Yousheng, WANG Zhijun, YU Hang, et al. Response of antioxidant enzyme activities and gene expression in different drought resistance cotton varieties under drought stress[J]. Acta Botanica Boreali-Occidentalia Sinica, 2015, 35(12): 2483-2490.
[19] Rajjou L, Duval M, Gallardo K, et al. Seed germination and vigor[J]. Annual Review of Plant Biology, 2012, 63: 507-533.
[20] 吉状状, 谭韵, 黄众基, 等. 基于海藻酸的包衣剂对甜玉米种子活力、抗氧化酶系统和产量的影响[J]. 核农学报, 2023, 37(11): 2297-2304.
JI Zhuangzhuang, TAN Yun, HUANG Zhongji, et al. Effects of seed coating agent based on alginic acid on seed vigor, antioxidant enzyme system and yield of sweet corn[J]. Journal of Nuclear Agricultural Sciences, 2023, 37(11): 2297-2304.
[21] 李防洲, 冶军, 侯振安. 外源调节剂包衣对低温胁迫下棉花种子萌发及幼苗耐寒性的影响[J]. 干旱地区农业研究, 2017, 35(1): 192-197.
LI Fangzhou, YE Jun, HOU Zhenan. Effects of seed film coating with exogenous regulating substances on cotton germination rate and cold tolerance of seedlings[J]. Agricultural Research in the Arid Areas, 2017, 35(1): 192-197.
[22] 王雅玲, 杨代斌, 袁会珠, 等. 低温胁迫下戊唑醇和苯醚甲环唑种子包衣对玉米种子出苗和幼苗的影响[J]. 农药学学报, 2009, 11(1): 59-64.
WANG Yaling, YANG Daibin, YUAN Huizhu, et al. Effects of seed-coating tebuconazole and difenoconazole on emergence of maize seeds and response of seedlings at chilling stress[J]. Chinese Journal of Pesticide Science, 2009, 11(1): 59-64.
[23] Chang K F, Conner R L, Hwang S F, et al. Effects of seed treatments and inoculum density of Fusarium avenaceum and Rhizoctonia solani on seedling blight and root rot of faba bean[J]. Canadian Journal of Plant Science, 2014, 94(4): 693-700.
[24] 李淑叶, 马慧娟, 张思平, 等. 外源24-表油菜素内酯对低温胁迫下棉花幼苗光合生理的影响[J]. 棉花学报, 2018, 30(3): 252-260.
LI Shuye, MA Huijuan, ZHANG Siping, et al. Effects of exogenous 24-epibrassinolide on photosynthetic physiology of cotton-seedlings under low temperature[J]. Cotton Science, 2018, 30(3): 252-260.
[25] 孔春艳, 赵静, 徐照丽, 等. 抗氧化系统参与水杨酸诱导烟草幼苗抗冷性提高的生化机制[J]. 热带作物学报, 2023, 44(1): 154-166.
KONG Chunyan, ZHAO Jing, XU Zhaoli, et al. Involvement of antioxidant system in salicylic acid induced-chilling resistance and biochemical mechanism in tobacco(Nicotiana tabacum L.) seedlings[J]. Chinese Journal of Tropical Crops, 2023, 44(1): 154-166.
[26] 郑子漂, 徐海江, 崔建平, 等. 水分胁迫对陆地棉生长发育的影响[J]. 新疆农业科学, 2022, 59(8): 1821-1830.
ZHENG Zipiao, XU Haijiang, CUI Jianping, et al. Effects of water stress on growth and development in cotton (Gossypium hirsutum L.)[J]. Xinjiang Agricultural Sciences, 2022, 59(8): 1821-1830.
Effects of the carboxin from seed coating formulation on the cotton seed germination and seedling agronomic characteristics under water and temperature stress
ZHOU Xiaoyun, ZHANG Jungao, LIANG Jing, GONG Jingyun, ZHOU Guangwei, ZHANG Shaomin, LEI Bin
(Research Institute of Nuclear Technology and Biotechnology, Xinjiang Academy of Agricultural Sciences /Xinjiang Research Center of Engineering and Technology for Crop Chemical Regulation, Urumqi 830091, China)
Abstract:【Objective】 The aim of this research is to investigate the effects of carboxin on seed germination and morphogenesis of cotton seedlings under low temperature and water stress.
【Methods】" In this study, the impact of carboxin on seed germination, as well as the morphology, physiological, and biochemical characteristics of cotton seedlings were analyzed.The experiment utilized an artificial climate chamber and controlled the water-holding capacity of potted sandy soil to simulate field conditions of low temperature and water availability.
【Results】"" The findings revealed that under low temperature stress, the germination rate of cotton seeds was reduced by 21.95%.However, when treated with carboxin, the germination rate increased by 14.06% compared with the low temperature stress alone.Similarly, drought stress caused a 29.41% decrease in seed germination compared with normal watering conditions, whereas carboxin treatment reduced this decrease to 11.67%.Furthermore, low temperature stress significantly reduced the plant height and root length of cotton seedlings, as well as biomass accumulation in the shoots.The stress also led to increased malondialdehyde content and relative permeability of the cell membrane.However, applying carboxin treatment resulted in a reduction of 14.71% and 24.14% in malondialdehyde content and relative permeability, respectively, under low temperature and water stress conditions.Regarding biochemical characteristics, soluble sugar was found to be the main substance under water stress, while soluble protein was predominant under low temperature stress.The highest contents of both soluble sugar and soluble protein were observed in the cotton seedlings coated with carboxin under low temperature and water stress, with increases of 15.56% and 20.14%, respectively.Additionally, under low temperature and water stress conditions, cotton seedlings coated with carboxin exhibited the highest antioxidant enzyme activity and higher expression of antioxidant enzyme-related genes.
【Conclusion】" Cotton seed germination and growth are negatively affected by low temperature and water stress, leading to oxidative damage in the leaves.In response to this oxidative stress, cotton seedlings activate mechanisms to scavenge reactive oxygen species and mitigate the damage.The application of carboxin shows promising results in enhancing the resistance of cotton seedlings to low temperature and drought stress.This is achieved by altering the levels of osmotic regulating substances, boosting the activity of antioxidant enzymes, and inhibiting membrane peroxidation.These findings suggest that carboxin has offered a new approach for cotton seedlings to mitigate the impact of environmental disasters and reduce losses.
Key words:carboxin; temperature; water holding capacity; seed germination; physiological indicators
Fund projects: Project of National Natural Science Foundation of China (32060429) ; Open Project of the Key Laboratories of Xinjiang Uygur Autonomous Region (2020D04017) ; “Three Rural Issues \" Backbone Talents Training Project of Xinjiang \"Tianshan Talents\" Training Program;key Ramp;D projects in Xinjiang Uygur Autonomous Region (2022B02001-2);Major Scientific R amp; D Program Project of Xinjiang Uygur Autonomous Region (2023A02003-5)
Correspondence author: LEI Bin (1973-), male, from Bazhong, Sichuan, researcher, doctor, research direction: pesticide redevelopment and crop chemical control technology research,(E-mail)leib668@xaas.ac.cn
基金项目:国家自然科学基金项目(32060429);新疆维吾尔自治区重点实验室开放课题项目(2020D04017);新疆“天山英才”培养计划“三农”骨干人才项目;新疆维吾尔自治区重点研发项目(2022B02001-2);新疆维吾尔自治区重大科技专项(2023A02003-5)
作者简介:周小云(1977-),男,重庆人,研究员,博士,研究方向为作物化控与生物技术,(E-mail)xiaoyunzhou77@126.com
通讯作者:雷斌(1973-),男,四川巴中人,研究员,博士,研究方向为农药研制及作物化控,(E-mail)leib668@xaas.ac.cn

