
DOI:" 10.13855/j.cnki.lygs.2024.03.003
摘" 要:由类病毒引起的苹果病害在中国苹果主产区普遍发生,严重制约苹果产业的健康发展。对采自不同地区的带有典型症状的弘前富士、南方脆及惠民短枝富士果实,进行苹果锈果类病毒(ASSVd)和凹果类病毒(ADFVd)检测,发现两种病毒能够共侵染。根据ASSVd和ADFVd保守序列设计通用引物,建立了能快速、同时检测两种类病毒的RT-PCR方法。
关键词:苹果锈果类病毒; 苹果凹果类病毒; RT-PCR检测
中图分类号:" S661.1" 文献标识码:" A
文章编号:" 1002-2910(2024)03-0010-04
收稿日期:2023-08-07
基金项目:山东省重点研发计划(乡村振兴科技创新提振行动计划)(2022TZXD008);山东省果品产业技术体系(SDAIT-06-03)。
*通信作者:张振鲁(1988-),男,山东惠民人,副教授,从事苹果病害抗性研究工作。E-mail: zzhenlu0526@sdau.edu.cn
作者简介:马宁(2000-),女,山东德州人,在读硕士研究生,从事果树分子生物学研究工作。E-mail:1535718054@qq.com
Rapid and simultaneous detection of ASSVD and ADFVd by a one-step RT-PCR method
MA Ning1, KONG Lingrong2, ZHANG Xueyong3, ZHAO Lingling3, YOU Chunxiang1, ZHANG Zhenlu1*
(1.College of Horticultural Science and Engineering, Shandong Agricultural University/National Apple Engineering Research Center, Taian, Shandong 271018, China; 2.Agriculture and Rural Bureau of Qufu, Jining, Shandong 273100, China; 3.Yantai Academy of Agricultural Sciences, Yantai, Shandong 264000,China)
Abstract:Viroid-induced apple diseases are widely distributed in the main apple producing areas in China, which seriously restricts the heathy development of apple industry. By analyzing the apple fruits of Hongqian Fuji, Nanfangcui and Huimin Duanzhi with typical symptom from different regions using RT-PCR method, it was found that both apple scar skin viroid (ASSVd) and apple dimple fruit viroid (ADFVd) were detected from the same sample, suggesting the co-infection of these two viroids. Moreover, a rapid detection method that could simultaneously detect the two viroids was established based on the designed primers from the conserved region of the two viroids. The one-step RT-PCR method will facilitate the rapid detection of ASSVd and ADFVd all at once in the future.
Key words:ASSVd; ADFVd; RT-PCR detection
中国是世界最大的苹果生产国和消费国。随着苹果产业的发展,苹果树感染病毒病的几率普遍升高。目前苹果生产栽培中常见的病毒主要包括苹果花叶病毒(Apple mosaic virus, ApMV)[1]、苹果褪绿叶斑病毒(Apple chlorotic leaf spot virus, ACLSV)[2]、苹果茎沟病毒(Apple stem grooving virus, ASGV)[3]、苹果茎痘病毒(Apple stem pitting virus, ASPV)[4]、苹果坏死花叶病毒(Apple necrotic mosaic virus, ApNMV)[5]、苹果锈果类病毒(Apple scar skin viroid, ASSVd)和苹果凹果类病毒(Apple dimple fruit viroid, ADFVd)[4,6]。
类病毒是由246~434个核苷酸组成的单链、共价闭合环状的RNA[7],主要通过机械接触、苗木、嫁接等直接或间接的接触进行传播[8],由类病毒引发的病害,危害多种经济作物如苹果、梨等[9,10]。ASSVd属于马铃薯纺锤块茎类病毒科(Pospiviroidae)苹果锈果类病毒属(Apscarviroid)[11],可引发苹果锈果病。苹果锈果病最初在中国东北地区发现,目前在中国苹果主产区均有发生[12]。研究发现,ASSVd侵染苹果后根据品种不同引起果实产生锈果型、花脸型和锈果-花脸混合型等症状,锈果型症状主要是在果实上生有与心室顶部对应的五条规则的木栓化斑纹,花脸型症状主要是在果皮表面形成圆形的黄绿色或红色斑点,锈果-花脸混合型呈现上述两种症状的复合症状[13]。苹果果实受ASSVd侵染后,果个变小,风味变差,严重影响果实的商品价值。ADFVd首次在意大利种植的苹果品种红星果实上被报道,因其表现出明显的凹果症状而得名[14]。其RNA由306~307个核苷酸组成,与ASSVd同为Pospiviroidae科Apscaviroid属成员,且二者的序列相似性为63.5%,包含了ASSVd基因组的整个保守区域[15]。赵英[16]等最早在新疆栽培的国光品种中检测到该病毒,侵染苹果后主要表现为果实畸形、果皮表面形成3~4 mm的凹形绿色斑点。此外,在金冠等一些苹果品种中也发现了与ASSVd侵染相似的斑点症状[17]。
有些类病毒存在潜伏侵染,且多种类病毒还可以复合侵染,对于植株本身和邻近植株都存在潜在风险。苹果树体一旦感染类病毒将终身带毒,目前尚无有效治疗手段。近年来苹果类病毒侵染在中国发生面积不断扩大,在山东、陕西、河北等苹果主产区常有报道。针对类病毒的危害特性,快速、准确的检测类病毒是预防树体染病的重点。目前类病毒检测方法主要有生物学检测[18]、高通量测序技术[19,20]、分子生物学检测[21,22]等。分子生物学检测技术近年来发展迅速,主要包括逆转录-聚合酶链式反应(reverse transcription-polymerase chain reaction,RT-PCR)、实时荧光定量PCR (quantitative real-time PCR,qPCR)以及核酸分子杂交技术等。RT-PCR检测技术以其操作简单、快速灵敏的优点成为当前常用的技术。
笔者对采自不同地区带有典型症状的弘前富士、南方脆及惠民短枝富士果实,进行ASSVd和ADFVd检测,根据ASSVd和ADFVd保守序列设计通用引物,建立了能快速、同时检测两种类病毒的RT-PCR方法。
1" 材料与方法
1.1" 试验材料
2022年10月从山东烟台、临沂、泰安3个地区采集带有ASSVd和ADFVd典型症状的弘前富士、南方脆、惠民短枝富士果实样品和对照样品(图1),取样后削取果皮,立即液氮冷冻,后置于-80 ℃保存。
1.2" 试验方法
1.2.1总RNA提取及cDNA合成" 取液氮保存的苹果果皮,用试剂盒法提取总RNA,用于反转录合成cDNA,作为PCR扩增的模板。
1.2.2引物设计及检测" 根据NCBI(https://www.ncbi.nlm.nih.gov/)数据库下载收录的不同地区、不同变种的ASSVd和ADFVd序列,利用DNAMAN软件进行序列比对,在同源性高的区域设计特异性引物扩增ASSVd和ADFVd基因序列。ASSVd引物序列为ASSVd-F: 5-ACGAAGGCCGGTGAGAAAG-3,ASSVd-R: 5-CGACGACGACAGGTGAGTT-3;ADFVd引物序列为ADFVd-F: 5-GTCGACGAAGGCTGGTAAG-3, ADFVd-R: 5-GACGACAGGTAAGTCTCTTCAC-3。反应体系为cDNA 0.5 μL,dNTP Mix(2.5 mmol/L)17.5 μL,上游引物和下游引物(10 μmol/L)各1.5 μL,ddH2O补足至30 μL。PCR反应条件为95 ℃ 3 min、95 ℃ 15 s、56 ℃ 15 s、72 ℃ 15 s,30个循环。
1.2.3 ASSVd和ADFVd通用引物检测" 利用DNAMAN软件进行序列比对,设计ASSVd、ADFVd通用引物,检测样品中是否同时携带ASSVd和ADFVd,引物序列为AS-AD-F: 5-ACCTGTCGTCGTCGACGAAGG-3,AS-AD-R: 5-TCCGCTCGACTAGCGGC-3。反应体系为cDNA 1.5 μL,dNTP Mix(2.5 mmol/L)25 μL,上游引物和下游引物(10 μmol/L)各2.5 μL,ddH2O补足至50 μL。PCR反应条件为95 ℃ 3 min、95 ℃ 15 s、56 ℃ 15 s、72 ℃ 15 s,40个循环。
2" 结果与分析
2.1" ASSVd和ADFVd特异性引物检测分析
利用引物ASSVd-F/R和ADFVd-F/R分别进行PCR扩增,均得到300 bp左右的条带,产物回收后连接到克隆载体pEASY-Blunt Simple上,转入DH5α感受态细胞,筛选得到阳性克隆载体后进行测序。利用SnapGene软件比对分析,结果表明ASSVd-F/R、ADFVd-F/R扩增序列分别与ASSVd陕西苹果分离物(GenBank登录号NC_001340.1)、ADFVd 陕西苹果分离物(GenBank登录号EF088665.1)全长序列完全一致,然后分别提取质粒得到ASSVd和ADFVd的阳性对照。
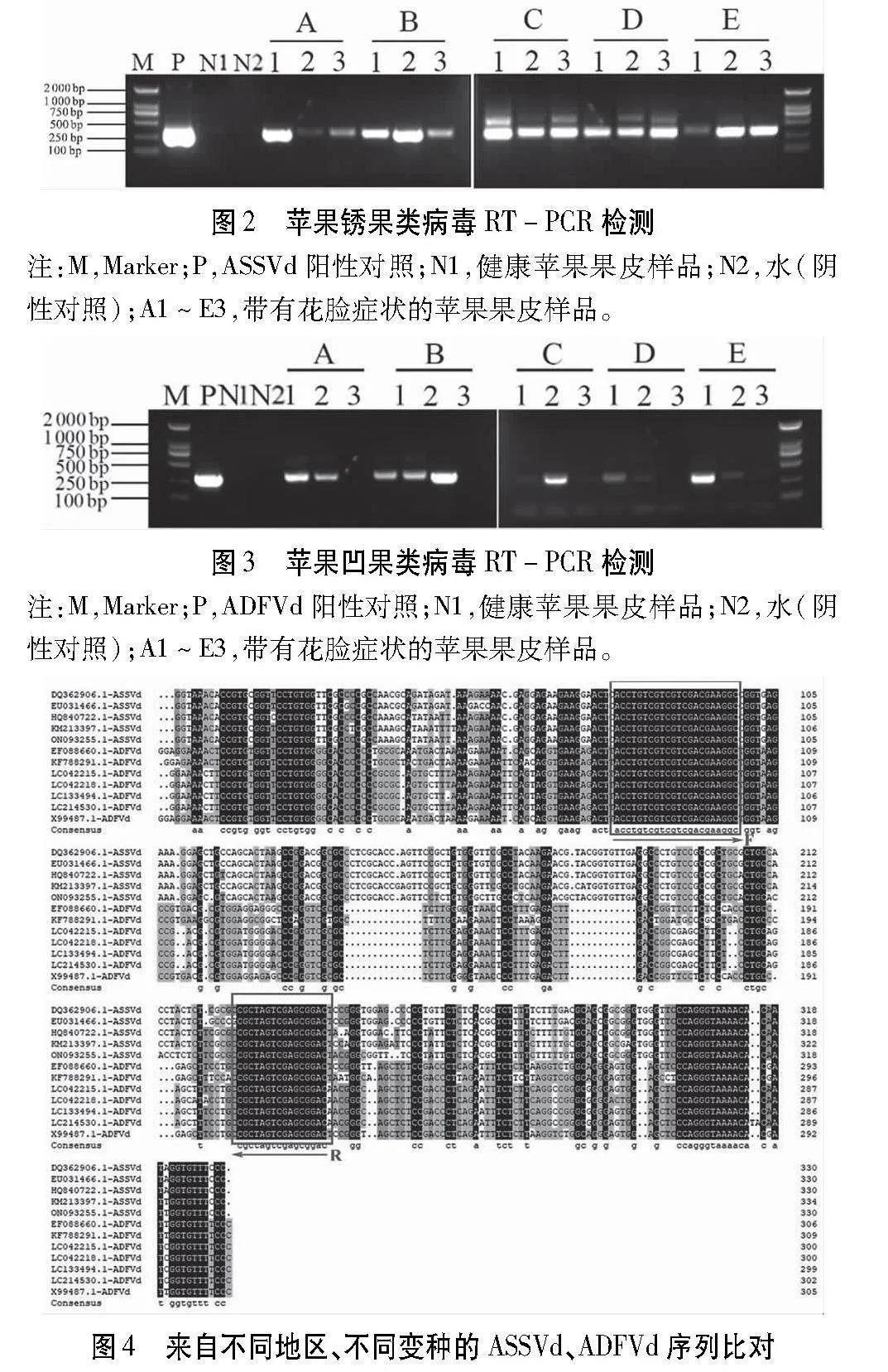
分别利用引物 ASSVd-F/R和ADFVd-F/R对带有典型症状的5个不同地区样品(A惠民短枝富士,烟台地区;B弘前富士,烟台地区;C惠民短枝富士,临沂地区;D南方脆,临沂地区;E惠民短枝富士,泰安地区)的苹果果皮及对照健康果皮进行RT-PCR检测,结果表明,ASSVd在带有典型症状的5个不同样品均检测出约300 bp的条带,且条带清晰明亮,在健康苹果果皮中未检测出条带(图 2)。ADFVd在A1、A2、B1、B2、B3、C2、D1、E1 8个样品中检测到单一且清晰明亮的条带,而在其他样品及健康果皮中没有检测到条带(图 3)。
2.2" ASSVd、ADFVd通用引物的设计及检测分析
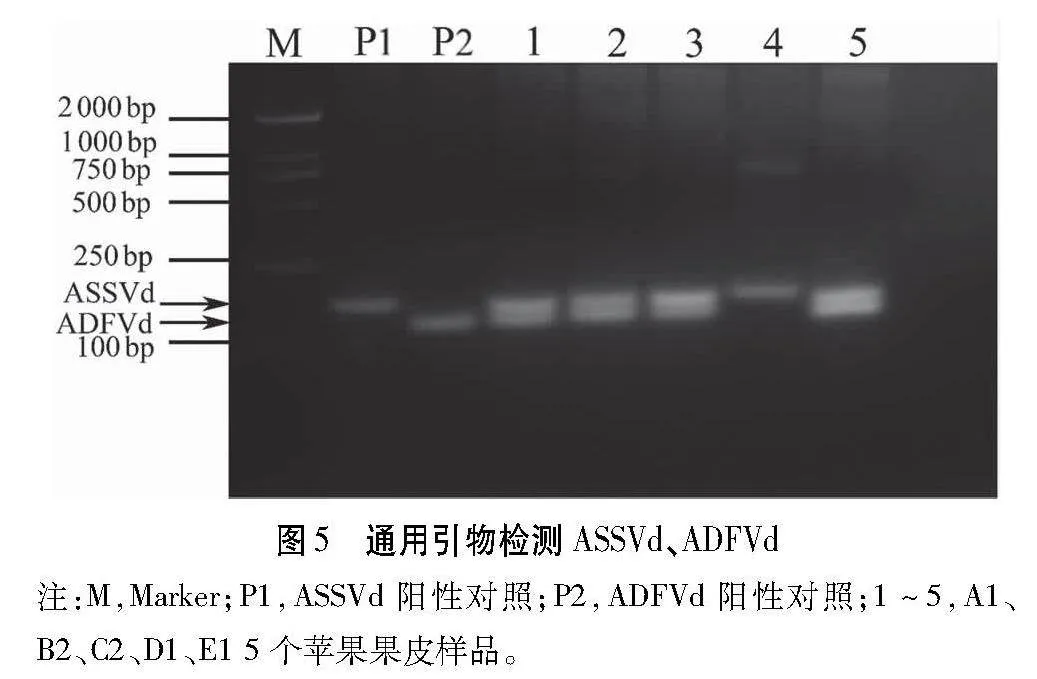
从NCBI选取5条ASSVd的不同序列和7条ADFVd的不同序列,利用DNAMAN进行保守序列分析(图4),并根据保守序列设计通用引物AS-AD-F/R进行PCR扩增,可获得165 bp的ASSVd条带和135 bp的ADFVd条带,通过3%的琼脂糖凝胶电泳可以区分两种类病毒。
为验证通用引物的准确性,根据图2和图3的检测结果,选取两种类病毒均能检测到的A1、B2、C2、D1、E1五个样品(依次命名1~5),并利用通用引物AS-AD-F/R进行RT-PCR检测(图5)。结果表明,除样品4外,其余4个样品均能分离出2个条带,即ASSVd为165 bp,ADFVd为135 bp。在样品4中仅检测到与ASSVd(165 bp)相似的序列。将PCR获得的DNA片段进行测序,结果表明165 bp的片段序列与ASSVd序列均一致,而135 bp的片段序列与ADFVd序列均一致。由上表明,本研究中设计的通用引物能够有效的区分ASSVd和ADFVd,可用于快速检测并区分两种类病毒。
3" 讨论
苹果类病毒侵染常通过嫁接、根系接触等方式进行传播,侵染树体后,会引起树势衰弱、叶片和果实发育不良,砧穗亲和力降低,严重影响苹果产业的健康发展。目前,苹果类病毒检测难以应用生物学检测、血清学检测等方法,而RT-PCR技术因其具有准确、高效、灵敏度高、适合大量样品检测等优点成为主流检测方法[22],其工作原理是将RNA病毒的反转录与PCR扩增技术相结合,尽早发现并清除病株[23]。使用RT-PCR技术对ASSVd、ADFVd进行检测,要综合考虑这两类病毒拥有大量变体,因而引物的设计应适用范围广,以便检测到感病样品中的类病毒。本研究通过NCBI数据库下载了不同变种的序列,利用DNAMAN软件进行比对,在保守区域设计引物,可以检测到感病样品中全部或大部分的ASSVd、ADFVd。在感病样品中同时检测到ASSVd、ADFVd两种类病毒,说明感病苹果中存在ASSVd、ADFVd复合侵染。
生产无病毒苗木需在苗木繁殖前后进行病毒病检测,以便能有效排除遭遇病毒侵染的植株,提高苗木质量。本研究根据ASSVd和ADFVd保守序列设计的通用引物可同时快速检测到ASSVd、ADFVd两种类病毒,对提高苹果类病毒的检测效率,保障无病毒苗木生产具有重要意义。
参考文献:
[1]" 李春霞. 苹果花叶病研究进展[J]. 陕西农业科学, 2021, 67(8):82-86.
[2]" 袁彧伟. 苹果褪绿叶斑病毒运动蛋白致病机制研究[D]. 呼和浩特:内蒙古农业大学, 2022.
[3]" 贾晓君, 胡国君, 张尊平, 等. 苹果茎沟病毒侵染对嘎拉苹果果实品质的影响[J]. 中国果树, 2023(3):18-22.
[4]" 丁磊, 崔正秀, 陈伟, 等. 山西苹果茎痘病毒遗传多样性分析[J]. 干旱区资源与环境, 2022, 36(2):141-146.
[5]" 邢飞, 王红清, 李世访. 中国苹果花叶病病原研究现状分析[J]. 果树学报, 2020, 37(12):1953-1963.
[6]" 吴然, 徐秋良. 我国苹果主要类病毒的研究现状[J]. 河北科技师范学院学报, 2017, 31(4): 27-30+55.
[7]" JOUBERT M, VAN Den Berg N, THERON J, et al. Transcriptomics advancement in the complex response of plants to viroid infection[J]. International Journal of Molecular Sciences, 2022, 23(14):7677.
[8]" HADIDI A, SUN L, RANDLES J W. Modes of Viroid transmission[J]. Cells, 2022, 11(4).
[9]" 袁彧伟, 付崇毅, 孙平平, 等. 苹果锈果类病毒内蒙古金红分离物的基因组序列分析[J]. 西北农林科技大学学报(自然科学版), 2022, 50(6):63-70.
[10]" 赵英, 牛建新. 梨树组织中的苹果锈果类病毒原位RT-PCR检测[J]. 分子植物育种, 2008(4):812-818.
[11]" DESVIGNES J C, GRASSEAU N, BOYE R, et al. Biological properties of apple scar skin viroid: isolates, host range, different sensitivity of apple cultivars, elimination, and natural transmission[J]. Plant Dis, 1999, 83(8): 768-772.
[12]" 刘永杰. 苹果病毒病的为害特征与防控措施[J]. 农家参谋, 2021(12):139-140.
[13]" 胡国君, 张尊平, 范旭东, 等. 我国主要苹果病毒及其研究进展[J]. 中国果树, 2017(3):71-74+82.
[14]" RUIZ-GARCIA A B, OLMOS A, MARAIS A, et al. Natural infection of pomegranate (Punica Granatum) by apple dimple fruit viroid[J]. Cells, 2022, 12(1).
[15]" DI Serio F, APARICIO F, ALIOTO D, et al. Identification and molecular properties of a 306 nucleotide viroid associated with apple dimple fruit disease[J]. J Gen Virol, 1996, 77(11): 2833-2837.
[16]" 赵英, 牛建新. 苹果凹果类病毒(ADFVd)的检测与序列分析[J]. 果树学报, 2008(5):682-685+786.
[17]" DI Serio F, GIUNCHEDI L, ALIOTO D, et al. Identification of apple dimple fruit viroid in different commercial varieties of apple grown in Italy[J]. Acta Hort, 1998(472):595-602.
[18]" 郗娜娜, 赵坷, 杨金凤, 等. 苹果花脸病田间病情发展及ASSVd在组培条件下的传播[J]. 园艺学报, 2020, 47(12): 2397-2404.
[19]" LOCONSOLE G, ONELGE N, POTERE O, et al. Identification and characterization of citrus yellow vein clearing virus, a putative new member of the genus Mandarivirus[J]. Phytopathology, 2012, 102(12):1168-1175.
[20]" 严佳文, 袁启凤, 解璞, 等. 利用小RNA测序技术检测贵州西番莲病毒[J]. 热带作物学报, 2019, 40(8):1577-1584.
[21]" 吕运霞, 李楠, 王亚迪, 等. 利用内标为基础的苹果锈果类病毒RT-PCR检测技术[J]. 河北林果研究, 2017, 32(1):51-56.
[22]" 吴凤, 吕丽兰, 吴静娜, 等. 环介导等温扩增技术在植物病原菌检测中的应用[J]. 农业研究与应用, 2018, 31(3):37-42.
[23]" 李桂芬, 李明福, 张永江. 植物类病毒检测技术概述[J]. 河南农业科学, 2007(3):19-21.
[24]" 杨金凤, 吕运霞, 唐兴敏, 等. 苹果锈果类病毒RT-PCR检测体系的建立[J]. 中国果树, 2015(5):62-67.