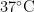鹅病毒性肝炎是一种急性传染病,发病迅速、传播范围广,死亡率高。该病主要由不良的饲养条件引发,包括饲料中缺乏必需的微量元素和维生素、管理不善、鹅舍潮湿通风不良以及饲养密度过高。幼龄雏鹅(7~20日龄)是主要的受害对象,成年鹅发病率较低,但感染病毒后会成为传染源。为保障养殖收益,本文详细介绍了鹅病毒性肝炎的病原体及其流行特征,深入研究了诊断方法和综合防治策略,旨在为相关从业者提供理论参考,确保鹅养殖业的可持续发展。
一、鹅病毒性肝炎的病原
鹅病毒性肝炎的病原体是鹅肝炎病毒,在我国各地都有分布。该病毒在鹅群中发现频率较高,发病率也相对较高。该传播途径较为复杂,在体外具有一定的毒性。鹅病毒性肝炎病毒对氯仿、甲醇和乙醚等有机溶剂抵抗力较强,但对碱性环境敏感。此外,它可耐受胰蛋白酶的作用,对酸性环境抵抗力较强。实验表明,该病毒可在鹅肾细胞中生长,导致细胞病变。病毒在潮湿的粪便中可存活长达37d,具有较强的耐热性,即使在56℃的温度下加热1h仍可存活。在 3 7 % 的环境中,它可存活超过 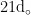
二、鹅肝炎病毒的致病机理
鹅肝炎病毒的致病机制尚不明确,但根据现有病理和分子生物学特征,可初步了解如下: ① 鹅病毒性肝炎病毒主要感染鹅的肝脏,导致肝脏严重损伤。病毒在肝细胞内大量复制,破坏细胞结构,引起肝脏肿胀、出血和坏死,最终导致肝功能异常和炎症反应。 ② 鹅病毒性肝炎病毒感染会对鹅的免疫系统造成不良影响。宿主会产生特异性的免疫反应,包括细胞免疫和体液免疫。但病毒可通过各种机制干扰或抑制宿主的免疫反应,削弱机体的免疫防御能力。 ③ 鹅病毒性肝炎病毒感染引发的肝脏损害会触发机体的炎症反应。炎症反应是机体对病毒感染的自然防御机制,但过度或持续的炎症反应会对组织造成损伤。 ④ 病毒在肝细胞内复制后,可通过粪便等排泄物和受污染的食物传播给其他鹅群。
三、鹅肝炎病毒的流行病学
成年鹅感染鹅病毒性肝炎的概率较低,但不当的饲养管理可能会导致成年鹅发生该病。例如,体内维生素和矿物质的缺乏、鹅舍环境过于潮湿、拥挤的饲养条件等,都可能成为诱发病情的因素。在大规模的养殖场中,春季孵化季节,鹅病毒性肝炎常常会大规模暴发,并且传播速度极快。在临床上,该病可被划分为急性、慢性和亚急性三种类型,其危害程度与雏鹅的年龄有关。通常情况下,雏鹅在不足5周龄时最容易感染此病,其中小于1周龄的雏鹅发病率高于 9 0 % ,而1~3周龄的雏鹅死亡率可达到约 5 0 % 。年龄超过5周的雏鹅则很少发生此病,成年鹅则多表现为隐性感染。该病在全国各地都有流行,其实北方地区最为常见。该病的主要传染源包括已经感染的鹅或携带病毒的雏鹅。病毒可通过含有病毒的粪便、受污染的饮水和饲料传播给其他鹅群。因此,养殖管理不当、鹅舍湿度过大、环境拥挤和卫生条件差等因素都可能导致该病的发生。
四、鹅病毒性肝炎传播机制
1、养殖密度与疾病传播的关联
养殖密度是影响鹅病毒性肝炎传播的一个关键因素。在高密度的养殖环境中,鹅只之间的接触相对频繁,这使得疾病传播的风险大大提高。高密度的饲养条件使得病毒传播有了更多的途径,拥挤的环境还会抑制鹅只的免疫系统,从而使它们更加容易感染疾病。在这种密集的养殖环境中,病毒可以通过多种途径传播。最常见的传播方式是直接接触,包括鹅只之间的身体接触以及共同使用被病毒污染的饲料和饮水。此外,粪便传播也是一种常见疾病传播方式,如果清理工作不到位或管理不当,会增加疾病感染的风险。除了直接的传播途径外,高密度养殖还可通过空气和尘埃传播的途径。在封闭或半封闭的养殖场内,病毒可以通过空气中的微小颗粒传播到不同的区域,从而扩大了疾病的传播范围。为了抑制鹅病毒性肝炎的传播,养殖管理者应当降低养殖密度。
2、环境卫生在疾病控制中的作用
良好的卫生环境可有效控制鹅病毒性肝炎的传播。养殖场的清洁状况与病毒传播的速度和范围有关。 ① 应当定期对养殖场进行彻底的清理和消毒,以减少病原体的数量,从而降低疾病在鹅群中的传播风险。在疾病暴发期间,彻底清洁和消毒可阻止疾病进一步扩散。 ② 鹅粪也是病毒传播的主要途径之一,因此养殖人员应当妥善处理粪便,防止其污染饲料和水源。 ③ 保障饲料和饮水的卫生,以避免饲料和水源成为疾病传播的途径。此外,合理规划养殖场布局同样关键。将不同生长阶段的鹅群分区饲养,能避免交叉感染。同时,优化养殖场的通风与排水系统,能降低环境湿度,抑制病毒滋生。完善的环境卫生管理体系,从多维度为控制鹅病毒性肝炎传播筑牢防线,全方位保障鹅群健康。
3、气候因素对病毒活性的影响
气候因素,如温度和湿度,对鹅病毒性肝炎病毒的活性和传播能力具有一定影响。温暖湿润的气候条件会促进病毒的传播。而极端的低温或干燥气候则会抑制病毒的活性,使其不易扩散。此外,季节性变化也影响疾病的暴发。例如,春季和秋季的气候条件相对温和,病毒在该时间段传播速度快,是鹅病毒性肝炎暴发的高峰期。除此之外,全球气候变化的趋势可能会进一步影响疾病的流行模式,如气候变暖,会使病毒变得活跃,从而增加了疾病的传播范围和发生频率。在气候过渡时期,昼夜温差大,鹅群应激反应增强,免疫力下降,更易感染病毒。这种气候波动下,鹅病毒性肝炎的防控难度也随之加大。
五、鹅病毒性肝炎的主要症状
1、鹅病毒性肝炎的特征
鹅病毒性肝炎的潜伏期一般为1~4d。在此期间,雏鹅发病较为突然,且发病持续时间较短。受感染的鹅会表现出明显的情绪低落,出现呼吸困难、精神沉郁、神情呆滞等症状。同时可观察到雏鹅出现进食困难的现象,发病严重时甚至会完全丧失食欲,发病的雏鹅行动迟缓,翅膀下垂,双眼呈现出茫然无神的状态。发病的姿态主要包括缩头弓背、孤立离群,眼睛半闭,呈现出半昏迷的状态,无法同其他鹅群走动。发病初期,雏鹅会出现腹泻,粪便呈水样或类似蛋花状,颜色可能为黄白色或绿色,并伴有难闻的气味。随着病情的恶化,症状会进一步加重,病羊会出现头颈部向后仰、运动失调、双脚痉挛和抽搐,甚至会出现翻滚、身体倾斜到一侧,呼吸困难,呈现出划水般的动作。病死的鹅,可观察到其背部反张的状况。受影响的雏鹅食欲显着下降,生长发育受到严重阻碍,每日增重减少。
2、病鹅剖检变化
在感染鹅病毒性肝炎的鹅体内,常见的病理特征包括眼窝的明显凹陷,以及胸腺的显着紫色肿大。肝脏会增大,肝细胞出现退行性变,质地变得脆弱。腹腔内往往充满了血液,颜色为黄红色或淡红色,表面散布有弥漫性的出血点或斑块。胆囊肿胀,内部充满褐色胆汁,脾脏也会肿大,质地变得坚硬且呈现斑驳状。胸部皮肤的颜色会较深,皮下静脉血管充盈的情况不明显。
心脏则显示出丝条状的变形,肺部可见散在的红色点状结节和紫红色斑块。肾脏的病理变化表现为充血和肿大,可出现坏死灶。喉部和气管会发生轻度的卡他性炎症,脑实质则会出现轻度的水肿和充血。
六、鹅病毒性肝炎的实验室诊断
1、细菌学检查
① 涂片镜检
经无菌操作取出雏鹅心血制作涂片,并取肝、脾制备触片,革兰染色后在显微镜下观察,未发现细菌。
② 细菌分离培养
在对病鹅进行实验处理时,首先应在无菌环境下通过放血的方式使其死亡。随后,将肝脏取出,提取样本,并将样本分别接种于四种不同类型的培养基上,主要为普通琼脂、麦康凯琼脂、巧克力琼脂和TSA琼脂。完成接种后的培养基被放置在 3 7 % 的恒温培养箱中,分别在需氧和厌氧条件下进行培养。为了保证结果的准确性,每隔24h对这些培养基进行一次观察,共进行为期5d的连续观察。最终,所有培养基上均未检测到任何细菌的生长,因此可排除细菌感染的可能性。
2、病毒的分离鉴定
① 病毒的分离
在无菌条件下,等量取病鹅和死亡鹅的肝脏、脾脏、心脏、脑等组织,混合剪碎并研磨,按1:5添加无菌生理盐水制成悬液。经过3次冻融后,加入 1 0 0 0I U / m L 青霉素和 1 0 0 0I U / m L 链霉素,充分混合静置 3 0 m i n ,取上清液进行无菌检测。若结果为阴性,则可作为分离病毒的样本。
② 动物试验
将20只7日龄的雏鹅随机分为两组,一组为实验组,皮下注射 1 m L 鹅源鸭甲型肝炎基因3型病毒高免卵黄抗体,另一组为对照组,接种等量生理盐水。24h后,两组雏鹅均皮下注射0 . 2 m L 病料上清液。结果显示,实验组雏鹅的存活率约为 9 0 % ,而对照组全部死亡。
七、鹅病毒性肝炎的治疗措施
在治疗鹅病毒性肝炎时应选择具有针对性的药物,预防继发性感染的发生。在发现病鹅后,应立即进行隔离,或视情况淘汰发病鹅群,以防止病毒传播扩散。在病情初期,可注射鹅源鸭甲型肝炎基因3型病毒高免卵黄抗体,进行治疗。同时,还可在饲料中适量添加抗病毒药物,如复合维生素B片、肝泰乐、黄芪多糖粉等,先将药物研成细末后与饲料混合,连续饲喂7d。此外,可按照配方在每千克饲料中加入6片黄芪多糖粉、10片肝泰乐、10片维生素C以及10片复合维生素B,连续使用 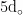 为提高疗效,还可以在饮水中添加药物治疗,建议每 5 0 k g 饮水中加入 5 g 氨苄西林和 5 0 g 营养补充剂(其主要成分包括维生素A、D3、E、C、B1、B2、B6、B12、叶酸、赖氨酸、甲硫氨酸、苏氨酸和肌醇等),让鹅群连续饮用2h,每天2次,疗程为3d,以此提高鹅的抵抗力,促进康复。
为提高疗效,还可以在饮水中添加药物治疗,建议每 5 0 k g 饮水中加入 5 g 氨苄西林和 5 0 g 营养补充剂(其主要成分包括维生素A、D3、E、C、B1、B2、B6、B12、叶酸、赖氨酸、甲硫氨酸、苏氨酸和肌醇等),让鹅群连续饮用2h,每天2次,疗程为3d,以此提高鹅的抵抗力,促进康复。
在治疗鹅病毒性肝炎时,还可采用中药配方治疗。使用甘草1 5 0 g 川楝子 3 0 0 g 、茵陈 4 5 0 g 连翘 3 0 0 g 、栀子 2 0 0 g 菊花 3 0 0 g 、龙胆草 2 5 0 g 、双花 3 0 0 g 、香附 2 0 0 g 、板蓝根 5 0 g 大黄 2 0 0 g ,兑水1 0 0 k g ,可供1000只雏鹅饮用,每日1次,连续4~5d,药渣可以混入饲料中使用。对于症状较重的鹅群,可用滴管将药液直接滴入口腔,每次10~12滴,每天2次。同时,辅助治疗措施包括在饲料或饮水中添加适量抗毒药物,对于发病鹅群,需要及时在饲料或者饮水中添加适量的板蓝根冲剂,每天1次,连续5d,或将清瘟败毒散与饲料均匀混合,每天喂2次,持续 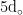 增加饲料中微量元素和维生素的含量,以满足其生长需求。此外,在天气晴朗的中午,应特别注意舍内的空气流通,及时排除有害气体,改善环境质量。同时,要严格控制舍内的湿度,避免湿度过高,定期更换垫草,保持舍内干燥。为减少鹅群受到的环境压力,还需确保养殖场内外保持安静,避免噪声和其他刺激因素引发应激反应,以防加重病情并影响鹅群的健康状况。
增加饲料中微量元素和维生素的含量,以满足其生长需求。此外,在天气晴朗的中午,应特别注意舍内的空气流通,及时排除有害气体,改善环境质量。同时,要严格控制舍内的湿度,避免湿度过高,定期更换垫草,保持舍内干燥。为减少鹅群受到的环境压力,还需确保养殖场内外保持安静,避免噪声和其他刺激因素引发应激反应,以防加重病情并影响鹅群的健康状况。
八、鹅病毒性肝炎的科学防控措施
1、鹅病毒性肝炎的疫苗免疫
在鹅病毒性肝炎的防控中,采用科学的免疫方式能有效降低损失率。疫苗免疫一般采用鹅源鸭甲型肝炎基因3型病毒高免卵黄抗体进行免疫,对于病雏鹅,可以通过皮下注射 1 . 5~2 . 0 m L 只的抗体溶液,有效提升其保护率。若无法确定雏鹅是否具备母源抗体,应立即注射卵黄抗体以预防感染。根据实验结果显示,当高免血清的抗体效价达到1:64以上时,能够抵御20个最强毒株,保护率可高达 9 0 %~1 0 0 % 。因此,对雏鹅进行一次预防性血清注射,能够显着降低感染风险。此外,疫苗的制备依赖胚胎培育过程,以确保疫苗的安全性与有效性。
种鹅在开产前可通过1~2次鹅病毒性肝炎减毒活疫苗与鹅流感油乳剂灭活疫苗,的配伍免疫,提高其免疫能力。同时,通过该种蛋免疫接种可传递母源抗体,使雏鹅在孵化后获得抗体保护,有效增强免疫力。此外,该种蛋白免疫接种对于种蛋的孵化率影响较小,并且能避免疫苗污染和大肠杆菌等问题。接种人员可在种鹅开产前12周、8周、4周分别接种鹅病毒性肝炎减毒活疫苗,以显着提升雏鹅的被动免疫效果。种蛋在孵化过程中可使用孵化箱或孵化机进行免疫接种。母源抗体的免疫期通常为6个月,随后需要进行第2次注射以维持免疫效果。在接种疫苗过后,抗体将通过种蛋传递给幼鹅,并且在14d左右就能获得母源抗体的保护。需要注意的是,具备母源抗体的雏鹅应在7~10d内接种弱毒苗,而没有母源抗体的雏鹅则需在出生1d内进行免疫。免疫过程中,可结合饮水免疫与皮下注射,进一步强化免疫效果。
2、病鹅隔离、消毒
在发生鹅病毒性肝炎传染后,应将病鹅立即隔离,同时彻底清理受污染的环境、用具和粪便,并对病死鹅及相关污染物进行焚烧或深埋处理,确保深埋地点远离水源以避免污染扩散。为防止疫情蔓延,必须禁止病死鹅进入市场或被随意丢弃入河流,并确保疫区鹅及其产品不得外运。若发生疫情,应第一时间上报相关部门,并及时通知周边养鹅场以做好防范工作,避免疫情扩散。此外,防疫人员应每日对发病鹅群进行带鹅消毒。在进行消毒工作前应先将舍内温度提高 2~3 % ,以防止鹅群产生冷应激,然后选择过氧乙酸对舍内环境及鹅体进行喷雾消毒,或使用癸甲溴铵溶液进行带鹅消毒,持续操作直至鹅群康复。由于鹅群在感染鹅病毒性肝炎后其对疾病抵抗力下降,饲养人员应在饲料中适量添加维生素A、D、E、K和C,以增强鹅群的抗应激能力并预防继发感染大肠杆菌病等。
综上所述,提高养鹅业收益的关键在于有效防控鹅病毒性肝炎这一高发疾病。由于该病发病迅速、死亡率高,防治工作尤为重要。养殖户可通过严格的免疫管理以降低疾病的发生率,尤其是定期进行疫苗接种,确保母鹅的抗体水平充足。此外,养殖场还需重视消毒措施,定期清洁消毒,防止病原扩散,同时应保持适宜的舍内温度,改善饲养条件,提供良好的育雏环境,注重提高鹅群的免疫力,以减少疾病的发生,进而确保养殖效益的稳步提升。
(作者单位:1.321300浙江省永康市动物疫病预防控制中心;2.321313浙江省永康市象珠镇人民政府)
 标题
标题