姜春乐,郭秀清,迟静
(1.桃村兽医站,山东 烟台 265300;2.临朐县畜牧局,山东 潍坊 262600;3.烟台市牟平区畜牧兽医工作站,山东 烟台 264100)
齐多夫定对J亚群禽白血病病毒的体内外抑制作用
姜春乐1,郭秀清2,迟静3
(1.桃村兽医站,山东 烟台 265300;2.临朐县畜牧局,山东 潍坊 262600;3.烟台市牟平区畜牧兽医工作站,山东 烟台 264100)
禽白血病病毒与人的HIV同属于反转录病毒,鉴于已有多种药物在控制HIV中起到了重要作用,本研究试图探索此类药物在辅助禽白血病病毒净化中的可行性,分别在体内和体外观察了齐多夫定对J亚群禽白血病病毒的抑制作用。首先通过在培养液中添加不同药物浓度连续传代以及利用CCK法测定细胞活性的方法,确定了在培养液中添加药物不超过5μg/ml的药物浓度对于DF-1细胞的复制没有影响。体外试验证实,当在培养液中添加5μg/ ml的药物时可以显着抑制J亚群禽白血病病毒在DF-1细胞上的复制,与不添加药物组差异显着;体内实验证实,在10mg/只/d连续用药7d情况下感染J亚群禽白血病病毒鸡群在前六周内病毒血症完全消除。本研究证实了齐多夫定在体内和体外对J亚群禽白血病病毒均具有明显的抑制作用,这有助于在检测淘汰的同时通过药物的辅助加速不同鸡群中禽白血病病毒的净化进程。
禽白血病病毒;齐多夫定;体内;体外;抑制作用
禽白血病(Avian leukemia,AL)是由禽白血病病毒/肉瘤病毒群病毒引起的禽类多种良性和恶性肿瘤性疾病,临床上多以免疫抑制、生长抑制和多器官组织出现肿瘤等为主要特征[1]。根据病毒囊膜蛋白和与病毒的宿主特异性相关的 gp85蛋白抗原性差异,禽白血病毒可分为A-J共10个亚群,其中只有A、B、C、D、E和J亚群能感染鸡[2-3]。
在上世纪80年代以前,A、B亚群ALV是引起鸡群淋巴性白血病和各类型肿瘤的主要亚群,但在80年代中期,西方大型种鸡公司已基本消除了鸡群中A、B亚型ALV的感染。而从上世纪90年代起,J亚群禽白血病在白羽肉鸡中广泛流行,给肉鸡业造成了很大的经济损失。经过几十年的净化措施,国际上多数大型种鸡公司也已基本净化了ALV-J感染。由于中国在禽白血病方面一直未进行全面的净化措施,我国不同鸡群中禽白血病病毒感染仍较普遍,其中J亚群多见报道[4-8],并且还不断有新的K亚群出现[9-10]。
禽白血病病毒与人的HIV同属于反转录病毒,与HIV一样,目前尚无有效的商品化疫苗用于ALV的预防。鉴于ALV主要通过垂直传播,国际上主要通过净化措施来控制 ALV,检测和淘汰ALV阳性种鸡。目前,国际上用于原种鸡群的最优净化方案是对核心鸡群全部采血接种 DF-1细胞,9d后检测P27抗原,凡阳性者全部淘汰。但是这一程序需要较高的实验室检测水平,也不适于大量样品的检测。
在HIV的控制中,通过多种药物及其组合已经较好的控制了HIV。我们有兴趣知道类似的药物是否可以通过控制HIV类似的策略来阻断或者至少降低ALV-J的感染。为此,本研究观察了齐多夫定对J亚群禽白血病病毒在体内和体外的抑制作用。
1 材料与方法1.1 细胞、病毒与抗体 对内源性E亚群ALV有抗性的DF-1细胞购自美国ATCC,其基础培养液为DMEM(pH7.2,GIBCO,USA),生长液中添加10%胎牛血清(FBS),维持液中添加2%FBS。ALVJ的NX0101株是2001年由本实验室从中国的宁夏回族自治区某父母代种鸡场分离到的野毒株[11],其传染性克隆rNX0101由本实验室制备和保存[12]。rNX0101在DF-1细胞上增殖后,上清液按照Reed-Muench法方法测定其TCID50为10-2.5TCID50/0.1mL。
1.2 药物与疫苗 药物齐夫多定(AZT)为葛兰素威尔康公司生产的药物原粉。在细胞上使用时,用细胞基础培养液DMEM配制所需药物浓度;在体内实验中使用时,用生理盐水配制所需药物浓度。鸡新城疫灭活疫苗以及 H9亚型禽流感灭活疫苗均购自梅里亚公司。
1.3 不同浓度AZT对DF-1细胞复制和活性的影响 AZT浓度过高会对DF-1细胞引起损伤,导致ALV-J的复制受到影响。为了确定对DF-1细胞复制的安全药物浓度,本研究通过在不同药物浓度培养液中连续传代和CCK细胞毒性测定两种方法来评估药物的安全使用范围。首先在细胞培养液中分别添加 120、100、60、40、20、5、3、2、1、0.5μg/ml的AZT,然后将上述不同浓度AZT培养液进行DF-1细胞的连续传代,至少传代15代以上,表示该药物浓度对DF-1细胞的复制没有影响。此外,通过 CCK-8试剂盒(Vazyme Biotech, China)测定了不同药物浓度对DF-1细胞的活性影响,具体操作参见试剂盒说明书[13]。
1.4 不同浓度AZT对ALV-J在DF-1细胞复制的抑制作用 在一个24孔细胞培养板中接种同等数量的DF-1细胞,待细胞长成为单层后1~20孔每孔接种rNX0101株500个TCID50,剩余21~24孔不添加药物作为空白细胞对照。2h后1~4孔换为维持液A,其中含有5μg/ml的AZT,5~8孔、9~12孔、13~16孔分别更换为含有 3、2、1μg/ml AZT的维持液,17~20孔不添加药物。接种ALV-J培养7d后,收取24个孔细胞上清液,以ALV-p27抗原ELISA检测试剂盒测定CEF细胞中的p27抗原并记录各个孔的S/P值,同时对不同组的细胞上清液按照Reed-Muench法方法测定其TCID50。
1.5 不同浓度AZT对海兰褐生产性能的影响 从经过ALV净化的种鸡场购买80只1日龄海兰褐商品代蛋鸡,1日龄颈静脉采血分离病毒,经鉴定无ALV、REV和MDV感染,将其分为A、B、C、D 4个组。其中A组不服用药物,作为空白对照组;B组从1日龄起每只鸡每天肌肉多点5mg AZT,连续用药 7d;C组从 1日龄起每只鸡每天肌肉多点10mg AZT,连续用药7d;D组从1日龄起每只鸡每天肌肉多点20mg AZT,连续用药7d。7日龄时免疫H9亚型禽流感灭活疫苗和新城疫灭活疫苗。分别在第 14、21、28、35、42、49、56、63d时对各组称重,并同时采集血清以血凝抑制实验(HI)分别测定针对H9亚型禽流感灭活疫苗和新城疫灭活疫苗抗体,观察不同药物浓度对海兰褐鸡体重和免疫机能的影响。
1.6 不同剂量AZT对ALV-J在海兰褐鸡内复制的抑制作用 从经过ALV净化的种鸡场购买80只1日龄海兰褐商品代蛋鸡,1日龄颈静脉采血分离病毒,经鉴定无ALV、REV和MDV感染,将其分为A、B、C、D 4个组,其中A组为空白对照组;B组从1日龄起每只鸡每天口服5mg,连续服药7d;C组从1日龄起每只鸡每天口服10mg,连续服药7d;D组仅攻毒ALV-J不用药。在首次用药后 2h对 B、C、D三个组均以 rNX0101感染,104TCID50/只。从第 一 周起每 周 采 集 抗 凝 血 ,4°1500rpm离心后接种CEF细胞进行病毒分离,检测各组病毒血症的阳性情况。
2 结果2.1 不同AZT添加浓度对DF-1细胞复制和活性的影响 当在培养液中加入浓度高于 5μg/ml的AZT时,DF-1细胞均无法正常传代;当在培养液中加入浓度3μg/ml及以下的AZT时,DF-1细胞可连续传代40代以上(表1)。在培养液中分别添加5、3、2、1、0.5μg/ml的AZT,使用CCK-8试剂盒测定药物浓度对细胞活性,在450nm下分别测定细胞的吸光度,连续观察160h,以吸光度值为纵坐标,时间为横轴,绘制折线图(见图 1),显示所用药物浓度都对细胞活性有轻微影响,但差异不明显。
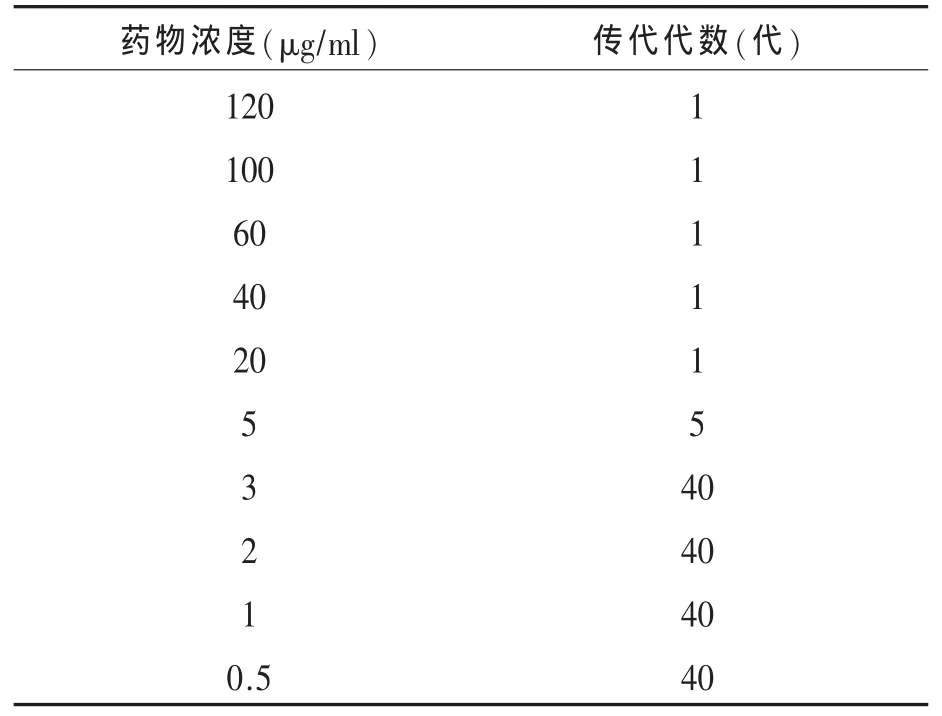
表1 添加不同浓度AZT对DF-1细胞传代的影响
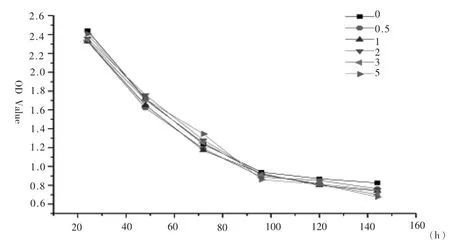
图1 不同药物浓度下吸光度值
2.2 不同AZT添加浓度对ALV-J在DF-1细胞复制的抑制作用 接种NX0101的DF-1细胞在分别含有 5、3、2、1、0.5μg/ml AZT的维持液中培养 7d后,收获细胞上清液,以 ALV-p27抗原ELISA检测试剂盒测定CEF细胞中的p27抗原并记录各个孔的S/P值,以ELISA检测的S/P值为纵轴,AZT添加浓度为横轴绘制柱形图 (图2),可明显观察到AZT明显的抗病毒作用。同时对各组病毒含量(TCID50)进行了测定(表2)。结果显示随着药物浓度的增加,rNX0101的复制受到的抑制作用随之增强。
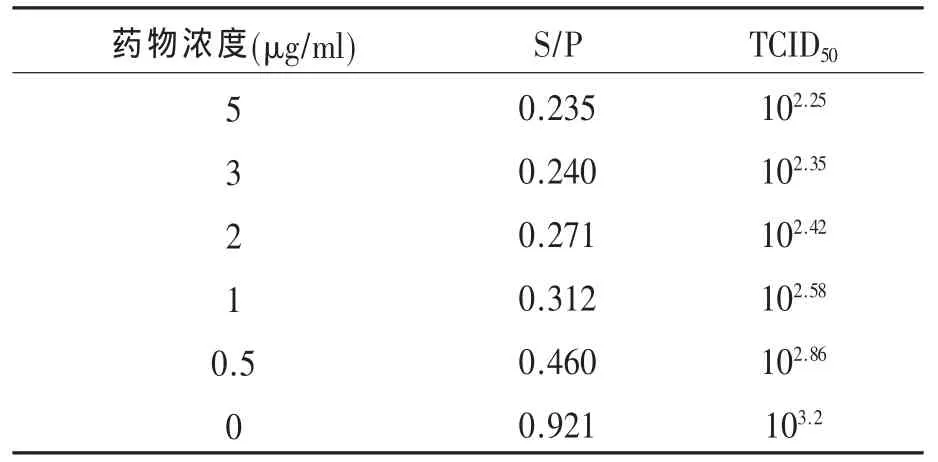
表2 不同药物添加浓度对ALV-J在DF-1细胞复制的抑制作用
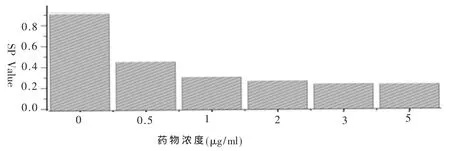
图2 不同药物添加浓度对ALV-J在DF-1细胞复制的抑制作用
2.3 不同浓度AZT对海兰褐鸡生产性能的影响 给海兰褐鸡每天分别服用5、10mg AZT和20mg,并连续使用7d,观察发现使用5mg和10mg AZT虽然造成了鸡比空白对照组的体重轻微下降,但差异不明显(图3),20mg组有明显死亡发生,这可能与对幼年小鸡注射过量液体有关,对于该组我们在后续的实验中将不予讨论。在免疫H9亚型禽流感灭活疫苗和新城疫灭活疫苗后4、6、8周后测定针对H9亚型禽流感灭活疫苗和新城疫灭活疫苗抗体显示服用药物对两种疫苗抗体滴度与空白对照组差异不显着,在某些情况下甚至会高于空白对照组(表3、表 4)。
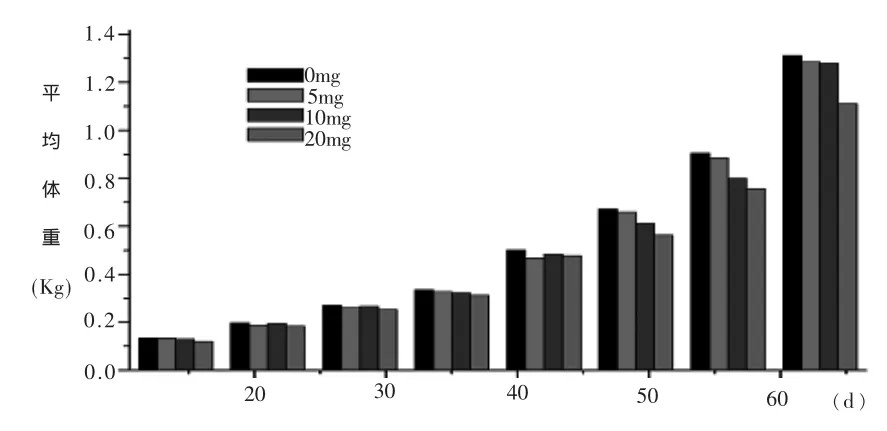
图3 每周各组体重平均值柱状图
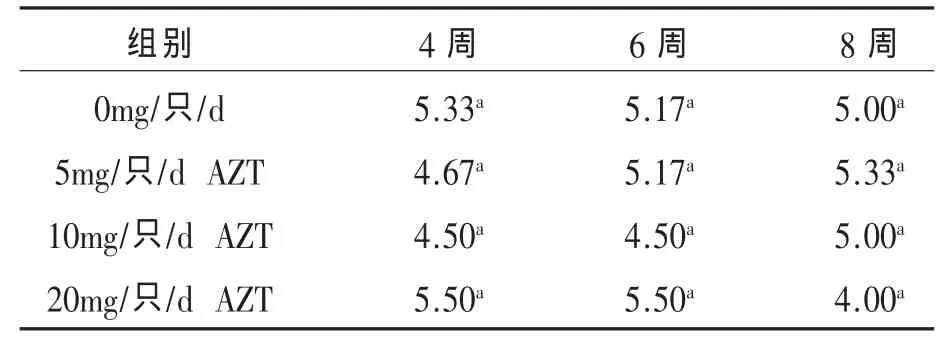
表3 用药组和不用药组在免疫新城疫后HI抗体滴度的影响
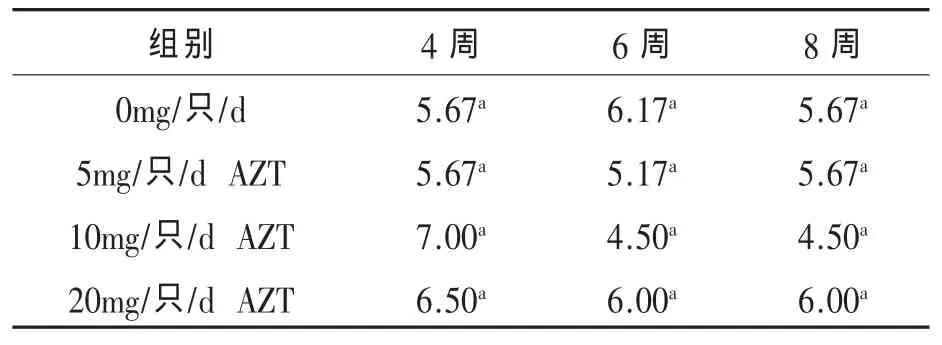
表4 用药组和不用药组在免疫禽流感H9疫苗后HI抗体滴度的影响
2.4 不同剂量AZT对ALV-J在海兰褐鸡内复制的抑制作用 未使用AZT的ALV-J感染组从第一周至第九周表现为持续病毒血症阳性,并维持在一个较高的水平。而使用10mg AZT的感染组到42d为止均未出现病毒血症。使用5mg AZT的感染组尽管前6周没有完全消除ALV-J的感染,但病毒血症阳性率也明显低于不用AZT的感染组,但病毒血症在第九周时完全消失(表5)。
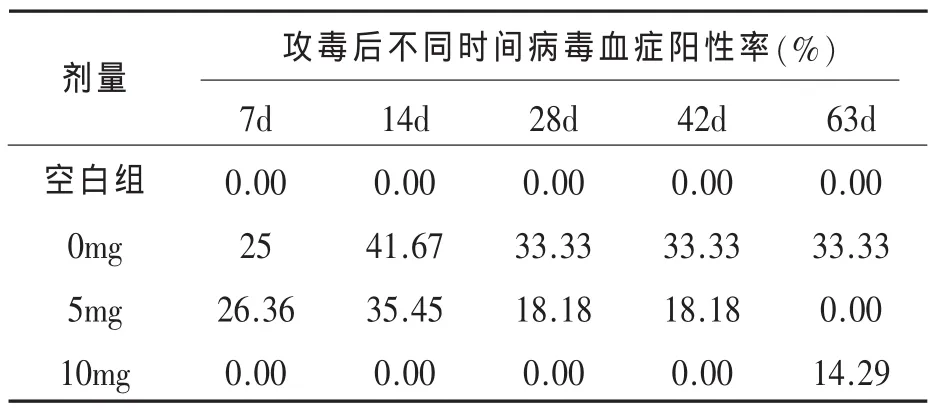
表5 不同日龄病毒分离阳性率
3 讨论近年来,不同鸡群感染ALV的报道在中国越来越多,特别是在一些地方品系鸡群中ALV感染的阳性率非常高,肿瘤类型也多种多样[14-15]。鉴于目前尚未有商品化的疫苗能够用于控制ALV,一些种鸡场不得不针对ALV开始实施严格的净化措施。目前,国际上用于原种鸡群的最优净化方案是对核心鸡群全部采血接种DF-1细胞进行外源性ALV的分离鉴定并全部淘汰阳性,这已经成为种鸡群净化的国际金标准。但是在执行这一标准时遇到了很多困难,因为在中国很多鸡群中ALV阳性率过高导致净化中淘汰过多严重影响了进化的进程[16]。
ALV与人获得性免疫缺陷病毒(HIV)同属于反转录病毒科,它们的基因组结构非常相似,即5-gag-pol-env-3,其中pol基因编码位于核芯中的反转录酶(RT)和整合酶(IN,P32),RT具有依赖RNA和依赖 DNA的聚合酶活性,IN是病毒核酸整合进宿主细胞所必须的,能将病毒核酸整合进宿主细胞染色体基因组中。针对这一特性,目前已经有很多药物应用于HIV的控制,如目前广泛使用的AZT[17-19]。AZT的分子结构与脱氧胸腺嘧啶核苷酸结构很相似,逆转录酶错将其利用,但因其脱氧核糖的第3位缺少羟基,不能与另一核糖核苷酸上第5位羟基与磷酸酯化相连,不能形成3,5-磷酸二酯键,DNA链的编码被中断,因而抑制了病毒的复制。泰国一项大规模的研究结果显示,在妊娠晚期和分娩期给予葛兰素威尔康公司生产的AZT使HIV的母婴传染率降低一半[20]。这种策略是否可以用于同样主要依靠垂直传播的ALV的控制呢?本研究从体内和体外两个方面观察了AZT对ALV-J复制的抑制作用。
在进行这一研究前确保所使用的药物浓度不会对宿主细胞或动物机体造成过度损伤是十分必要的,如果细胞状态较差会导致ALV-J在细胞上不能复制,而这种抑制并不是药物本身对ALV-J的抑制作用。目前常用的方法是用CCK测定使用药物后的细胞活性,利用这一方法测定结果显示在添加5μg/ml浓度以下情况下,DF-1细胞的活性几乎不受影响。此外,本研究还通过DF-1细胞在添加不同浓度AZT的细胞培养液中连续传代来不同浓度对DF-1细胞复制的影响,结果显示在添加3μg/ml的培养液中DF-1细胞可以连续传代40代以上。在鸡体中我们观察了不同药物浓度对鸡体重以及免疫机能的影响,结果显示在每天使用5mg情况下鸡的体重与免疫机能几乎不受影响。在此基础上我们分别通过在DF-1细胞接种ALV-J和给海兰褐鸡感染ALV-J后使用不同浓度AZT的方式评估了AZT在体内和体外对ALVJ复制的抑制作用,结果显示不管是体内还是体外AZT均能够显着抑制ALV-J的复制。
考虑到AZT在控制 HIV过程中产生的大量耐药毒株的报道[21-22],本研究建议 AZT的使用不能维持过长的时间特别是不能一直持续用药,为此本研究仅用药7d即停止喂药,即便如此,AZT对ALV-J的抑制作用仍然是非常明显的,很多ALV-J感染鸡在后期的连续观察中病毒血症为阴性。特别是当每只鸡服用3mg AZT情况下,所有鸡在63d时病毒血症全部转为阴性。
需要强调的是,药物的使用不能够替代针对ALV的净化,因为它无法确保使感染鸡的病毒血症100%消除。因此它的作用主要是针对一些感染率极高的品系,如中国一些非常宝贵的地方品系鸡群,在进行净化的同时以药物降低病毒血症阳性率来加速净化的进程,因此仅可以作为净化措施的补充。这一措施还有一个潜在的优势是,通过药物的使用降低了ALV的病毒血症水平,这有助于鸡体产生针对ALV的抗体加速清除ALV。
[1] SAIF Y M,BARNES H J,GLISSON J R,et al.Disease of poultry [M].11th ed.Iowa:Iowa State University Press,2003:64-81.
[2] COFFIN J M.Structure and classification of Retroviruses [M]Levy J A (Ed).The Retroviridate.New York: Plenum Press,1992,vol.1:19-49.
[3] 高玉龙,秦立廷,王笑梅.家禽病毒性免疫抑制病流行特点与防控对策[J].中国家禽,2012,34(15):5-11.
[4] 崔治中,张志,杜岩.我国肉用型鸡群中J亚群白血病流行现状的调查 [J].中国预防兽医学报,2002,24(4):292-294.
[5] XU B,DONG W,YU C,et al.Occurrence of avian leukosis virus subgroup J in commercial layer flocks in China [J].Avian Pathol,2004,33(1):13-17.
[6] CHENG Z Q,ZHANG L,LIU S D,et al.Emerging of avian leukosis virus subgroup J in a flock of Chinese localbreed[J].J Microl,2005 45(4):584-587.
[7] 王辉,崔治中.蛋鸡 J亚群白血病病毒的分离鉴定及序列分析[J].病毒学报,2008,24:369-375.
[8] 赵冬敏,张青婵,崔治中.芦花鸡中B亚群禽白血病病毒的分离与鉴定[J].病毒学报,2010,26(1):53-57.
[9] 王鑫,赵鹏,崔治中.我国地方品种鸡分离到的一个禽白血病病毒新亚群的鉴定[J].病毒学报,2012,28 (6):609-614.
[10] Cui N,Su S,Chen Z,Zhao X,Cui Z.Genomic sequence analysis and biological characteristics of a rescued clone of avian leukosis virus strain JS11C1, isolated from indigenous chickens.JGen Virol. 2014 Nov;95 (Pt 11):2512-22.doi:10.1099/vir. 0.067264-0.Epub 2014 Jul 9.
[11]Cui Z,Du Y,Zhang Z,et al.Comparison of Chinese field strains of avian leukosis subgroup J viruses with prototype strain HPRS-103 and United States strains[J].Avian Dis,2003,47(4):1321-1330.
[12]张纪元,崔治中,丁家波,等.J亚群白血病病毒NX0101株感染性克隆化病毒的构建及其致病性[J].微生物学报,2005(3):437-440,485.
[13] 熊建文,肖化,张镇西.MTT法和CCK-8法检测细胞活性之测试条件比较 [J].激光生物学报,2007,16(5):560-562.
[14] 朱美真,吴玉宝,崔治中.地方品系鸡中一株 A亚群鸡白血病病毒的分离和鉴定 [J].中国动物传染病学报,2009,17(4):31-35.
[15] 边晓明,李德庆,赵鹏,等.三群商品代蛋鸡 J亚群白血病跟踪观察 [J].中国农业科学,2013,46(2): 409-416.
[16] 崔治中.鸡白血病及其鉴别诊断和预防控制[J].中国家禽,2010,32(8):1-12.
[17] Lin TS,Schinazi RF,Chen MS,Kinney-Thomas E,Prusoff WH.Antiviral activity of 2,3-dideoxycytidin-2-ene(2,3-dideoxy-2,3-didehydrocytidine)against human immuno deficiency virus in vitro[J].Biochem Pharmacol.1987 Feb 1;36(3):311-6.
[18] Jablon L.Azidothymidine(AZT)[M].Conn Med.1987 Jul;51(7):453-4.
[19] Hopkins S.Zidovudine treatment for AIDS[J].Nurs Times,1987,83(39):64-5.
[20] 马振英.短期用齐多夫定治疗和阻断HIV的母婴传染[J].国外医学药学分册.1998,25(5):305.
[21] Jing Zhanga,Tingjun Houb,Wei Wangc,and Jun S. Liua.Detecting and understanding combinatorial mutation patterns responsible for HIV drug resistance[J].PNAS,2010 107(4):1321-1326.
[22] Bianca Bruzzone,a Antonio Di Biagio,b Laura Sticchi,a,c Renata Barresi,a Francesco Saladini,d Giancarlo Icardi,a, c Maurizio Settie.Feasibility and Reproducibility of HIV-1 Genotype Resistance Test in Very-Low-Level Viremia[J].Antimicrobial Agents and Chemotherapy 2014,58(12):7620-7621.
S859.79+6
B
1673-1085(2017)01-0011-05
2016-12-14