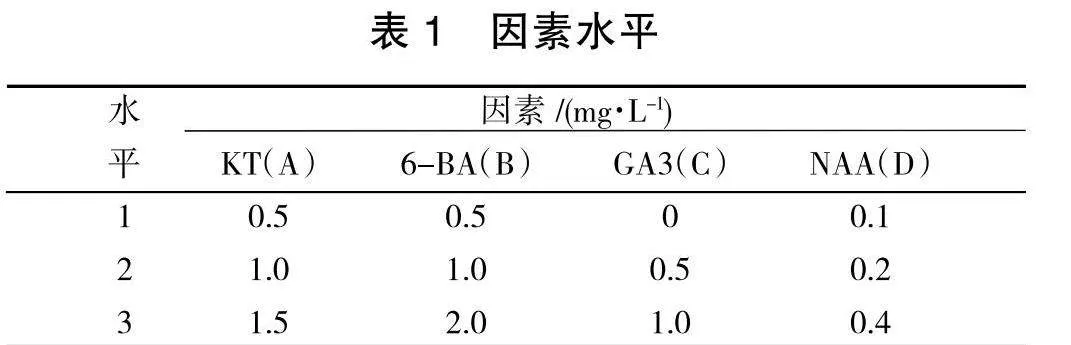
摘要:" 以刺五加腋芽为材料,研究了压切培养技术对试管苗增殖的作用,筛选出增殖培养基配方:MS+KT1.0 mg/L+6-BA1.5 mg/L+NAA0.2 mg/L。结合此技术诱导试管苗分化,增殖倍数达4.0倍,可使新分化的芽苗快速进入自主生长,叶片展开,生长势强,有利于培养试管壮苗,为生根培养奠定基础。
关键词:" 刺五加;" 压切技术;" 增殖培养
中图分类号:" "S 567. 1 + 90. 43" " " " " " " "文献标识码:" "A" " " " " " " " 文章编号:1001 - 9499(2025)01 - 0013 - 04
Effect of Pressure-cutting Culture on Differentiation andProliferation in Stem Tips of Acanthopanax senticosus
TIAN Xinhua GUO Qi WANG Fude LI Yanxia**
(Forestry Research Institute of Heilongjiang Province," Heilongjiang Harbin 150081)
Abstract In order to clarify the effect of pressure-cutting culture on the proliferation of tube seedlings, we used axillary buds of Acanthopanax senticosus as the study material and screened the proliferation medium: MS+KT1.0 mg/L+6-BA1.5 mg/L+NAA0.2 mg/L. We found that a 4-fold increase in stem tip proliferation of tube seedlings, and led to a rapid growth of newly differentiated axillary buds, leaf unfolding and vigorous growth. This study facilitates the optimization of tube seedlings and provides a basis for rooting culture.
Key words Acanthopanax senticosus; pressure-cutting culture; proliferation culture
刺五加(Acanthopanax senticosus)为五加科,多年生落叶灌木,主要分布在中国东北、华北、陕西及俄罗斯和朝鲜等地[ 1 ] 。刺五加的根、根茎、根皮均可入药,具有益气健脾、补肾安神、抗肿瘤、增强机体免疫力的功效[ 2 - 4 ],是极其珍贵的药物资源。刺五加的嫩芽可以作为蔬菜、茶叶,因其含有皂苷、黄酮、挥发油等特殊成分,营养价值也非常髙[ 5 - 7 ]。
刺五加种子质量差,存在严重的生理后熟[ 8 ],经处理后萌发率仍低于30%[ 9 ]。刺五加组培过程一直存在微体生长速度慢、分化增殖困难,苗木不生根等技术难题,组织培养技术体系尚不成熟,严重制约了刺五加良种化进程。因此,本试验通过对刺五加优良单株展开研究,采用原创压切培养方法,结合激素种类和浓度的筛选,攻克微体培养过程中的技术难关,提高苗木存活率,培育出试管壮苗,促进苗木生根,建立完善的组培体系,从而推动优良品种的推广与应用。
1 试验材料与方法
1. 1 供试材料预处理
2月初采集伊春市金山屯林场的刺五加优良单株休眠枝条为供试材料,用清水反复冲洗,然后置于有光照的室内,温度控制在20~25 ℃,待休眠芽开始萌动即可利用。
1. 2 外植体的灭菌处理
待腋芽萌发后,剪取长约1.0 cm的单芽茎段,用软毛牙刷刷洗带刺茎段,放入烧杯中上面覆盖纱布,流水冲洗2 h。在超净工作台上进行不同灭菌处理:
(1)2% NaClO浸泡4 min,用无菌水冲洗3次;
(2)75% 酒精浸泡30s,0.1% HgCI2浸泡2min,然后用无菌水冲洗3次;
(3)紫外线直射5 min,0.1% HgCI2浸泡4 min,然后无菌水浸泡30 min;
(4)0.1% HgCI2浸泡6 min,然后无菌水浸泡30 min。
以上材料灭菌后取出,用无菌滤纸吸干材料表面多余水分。每组处理8个腋芽,重复2次,7 d后观察效果。
1. 3 诱导侧芽生长
在超净工作台的无菌环境下,将带芽的茎段接种于MS+KT 1.0 mg/L+NAA 0.2 mg/L+6-BA 0.4 mg/L+30 g/L蔗糖 +琼脂粉6 g/L培养基上(pH值调至5.8~6.0),诱导芽苗生长。
1. 4 压切培养与试管苗分化增殖
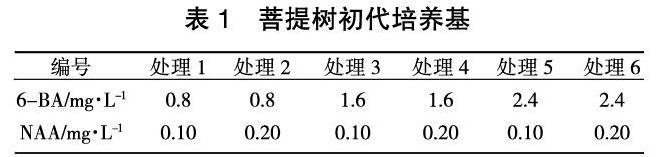
待腋芽伸长、叶片展开后,转接于以MS为基本培养基,分别添加不同浓度激素的培养基中进行培养(表1),培养基中添加蔗糖30g/L,日产琼脂粉6 g/L。采用L9(34)正交试验设计表进行试管苗增殖培养基筛选。每个处理接种10瓶,重复2次,无菌条件下结合压切技术培养试管苗,40 d后调查苗木的长势及分化情况。
1. 5 培养条件与数据统计
培养温度控制在(24±2)℃,光照强度2 000 Lux,光照时长12 h/d。采用dps19.05统计软件进行方差分析和差异显著性测验(LSD法)[ 11 ]。
2 结果与分析
2. 1 不同灭菌处理的效果
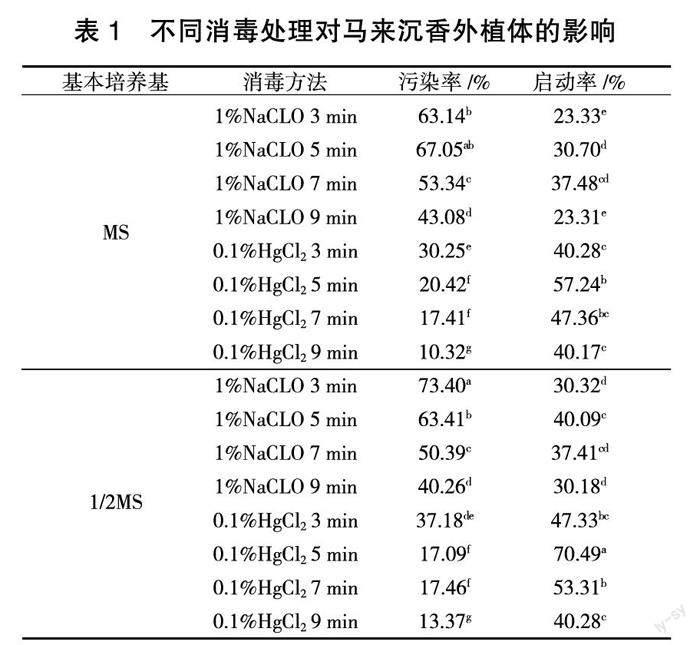
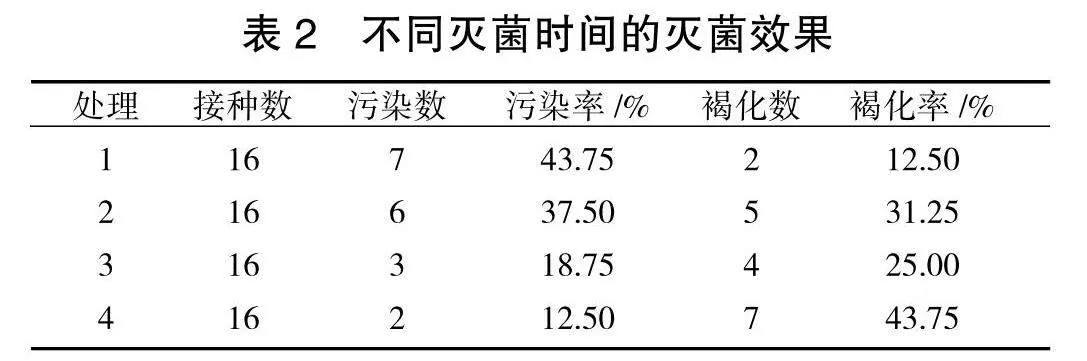
获得无菌材料是组织培养过程的重要初始环节,要求选用的灭菌方法在保证对外植体损伤、褐化最小的前提下,降低污染率。由表2可见,处理1灭菌不充分,污染率较高(43.75%);处理4灭菌过度,尽管污染率较低,但苗木损伤严重,大量褐化,严重影响外植体生长,甚至导致外植体死亡;处理3污染率为18.75%,褐化率25.00%,其他外植体均表现正常,是较适宜的灭菌方法。
2. 2 诱导侧芽生长
将获得的无菌外植体转接入MS+KT 1.0 mg/L+ NAA 0.2 mg/L+6-BA 0.4 mg/L培养基上诱导培养10 d左右开始萌动,经一周培养叶片展开,培养30 d后新生出叶片4~5片,叶片展开,叶色新绿,但主茎生长缓慢。在培养过程中每培养一周时间就转接入新的培养基中,这种方法可减少褐化的产生。
2. 3 压切技术在试管苗分化增殖培养中的应用
2. 3. 1 植物压切培养技术
压切培养技术是经长期试验摸索总结出来的一种试验操作技术,该技术适用于无主茎或主茎生长缓慢,增殖困难,分化苗弱、成苗率低的植物。利用此项技术,在保证新分化出的幼苗获得足够营养的同时,又为其独立生存创造条件,从而有利于提高分化苗的存活率,有利于培育出健壮试管苗,为生根培养奠定物质基础。
2. 3. 2 结合压切培养技术筛选增殖培养基
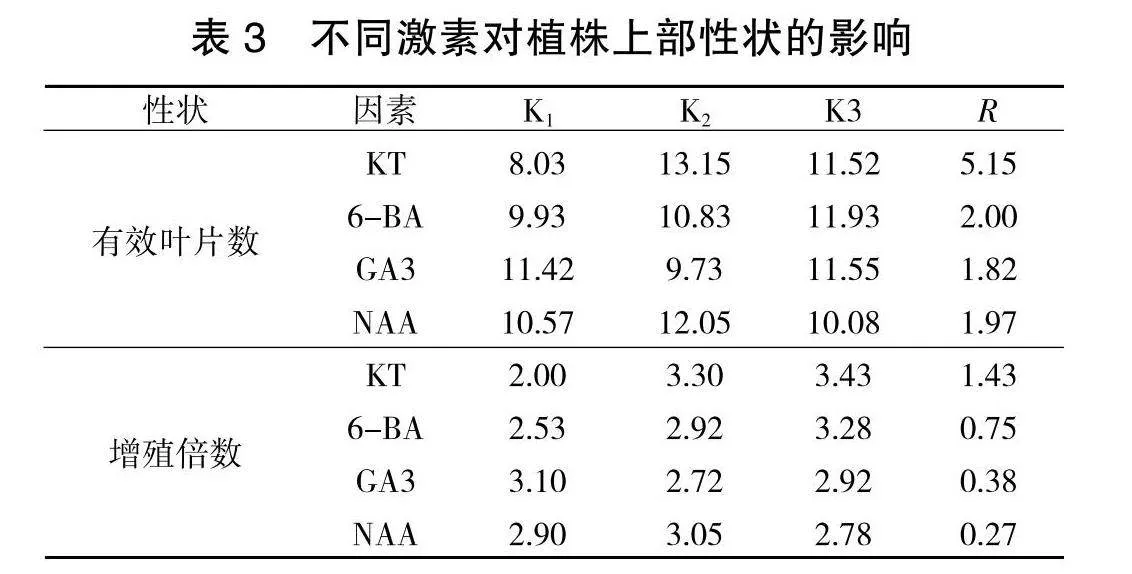
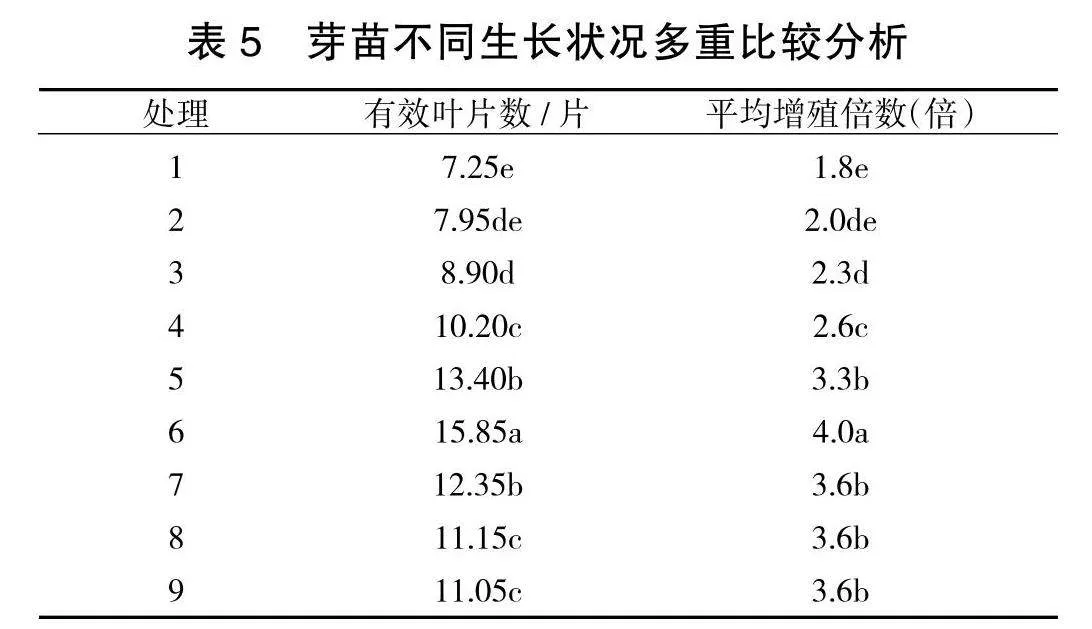
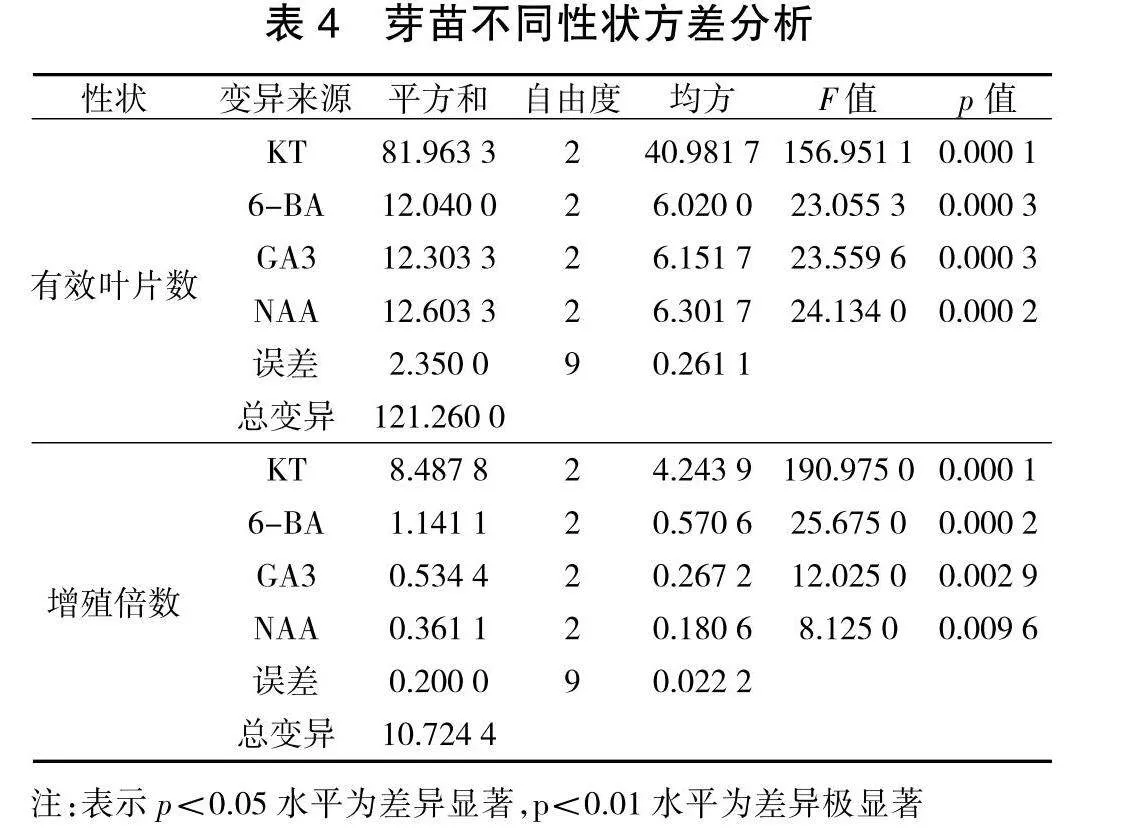
将经诱导培养的基础苗分别转入不同增殖培养基中培养20 d后,待有分化苗产生后,在超净工作台无菌条件下,利用镊子整体夹出,采用压切方法部分切割,给分化苗基部造成伤口,然后整体转接入相同处理的新培养基中,继续培养20 d后,观察到伤口处慢慢长出白色营养瘤,新分化出的小苗叶片展开,叶色转绿,生长势强于未经压切培养处理的分化苗。然后将分化苗彻底分离,独立培养,获得健壮的试管苗。试验结果经极差分析(表3),从各因素对苗木性状影响的极差结果反应:对于试管苗有效叶片数性状而言,A因素极差5.15,B因素2.00;C因素1.82;D因素1.97;对于增殖倍数而言,A因素极差1.43,B因素0.75;C因素0.38,D因素0.27;即无论从有效叶片数还是分化增殖情况来讲,KT(A)都是决定苗木生长分化的重要因素。从各因素对苗木性状影响的均值结果反应: 对于试管苗有效叶片数性状而言,A因素的均值K2>K3>K1,B因素K3>K2>K1;C因素K3>K1>K2;D因素K2>K1>K3;对于增殖倍数而言,A因素的均值K3>K2>K1,B因素K3>K2>K1;C因素K1>K3>K2,D因素K2>K1>K3,即对苗木生长状况影响最大的因素A(KT),其次是B因素(6-BA),并且分化数随着他们浓度升高而增加。但在试验中苗木还有其他反应:即随他们浓度增高,主茎生长会更慢,易形成丛生苗,叶片小,色淡,分化苗不易分割,分离往往造成苗木损失。方差分析结果(表4)表明,各因素间差异极显著(p<0.01)。按F值大小分析,影响苗木有效叶片数、分化增殖的主要因素仍是KT。按照植株上部生长情况的多重比较结果显示(表5),以处理6培养的试管苗分化增殖苗数较多,叶片展开,有效叶片数也较多,便于压切培养,培养过程中苗木损失少,且与其他处理差异显著。因此,选择培养基(即处理6)MS+KT 1.0 mg/L+6-BA 1.5" mg/L+NAA 0.2 mg/L为刺五加的分化增殖培养基,分化苗数较多,叶色深绿,顶芽新绿,植株生长健壮。
2. 3. 3 压切培养对苗木生长的作用
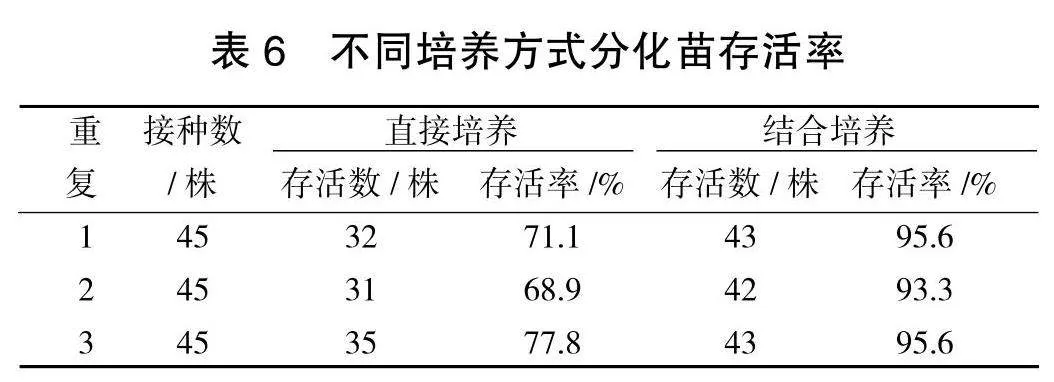
将经压切技术与增殖培养(处理6)相结合培养的苗木与直接分化培养的苗木进行对比:结合培养出来的分化苗顶芽新绿,下部叶色深绿,叶片展开,主茎较粗,分离母体后可快速吸收营养,启动自主生长能力强,存活率比直接切离母体的试管苗提高20%左右。
3 讨 论
3. 1 刺五加属于药食兼用植物,一般长梗刺五加用作药用,短梗刺五加做为蔬菜。从基础苗木培养方面看,菜用品种更易培养,生长分化速度也较快;药用品种则需要较长时间的前期积累,因品种不同无菌苗可能需要2个月左右的预培养,才能转接入分化增殖培养阶段。
3. 2 在植物组织培养中易出现外植体或培养物褐化现象,这主要是切割外植体使植物受到创伤刺激,细胞内的酚类物质流出,被氧化为褐色的醌类物质,产生褐变现象,导致植物生长受阻,甚至死亡,又称之为酚污染现象[ 10 ]。目前可以通过不同的处理方法抑制外植体褐变:加入抗氧化剂、吸附剂、改变渗透压[ 12 ]或低温处理[ 13 ]等,但不同物种抑制褐变的方法也不尽相同,应结合植物的具体生长情况选择适宜的方法。本试验在初代培养时通过不断转换培养基减少褐变,效果较好。
3. 3 刺五加属于不易打破自身生物调控的植物,先要获得理想的培养结果,应结合生长季进行。压切培养是一种新型培养技术,适用于无主茎或主茎生长缓慢、不易伸长的植物。通过与其他培养方法结合,可以大大减低苗木死亡,有效提高分化苗存活率。
参考文献
[1] 胡秀艳," 朱显玲," 王占新." 刺五加人工栽培技术[J]." 特种经济动植物, 2020, 23(7): 23.
[2] 粟杰," 冯艳," 林炳锋." 刺五加化学成分的分离与鉴定[J]." 中草药, 2021, 52(16): 4783 - 4788.
[3] 陈雁," 陈汉坤," 朱伟." 刺五加的研究进展和产业化应用[J].2024, 4(34): 312 - 320.
[4] 邢合龙." 辽西地区刺五加育种及林下种植管理技术研究[J].中国林副特产, 2020,6(169): 40 - 44.
[5] 鲁招弟." 刺五加经济价值及栽培技术[J]." 世界热带农业信息, 2022(5): 31 - 33.
[6] 张顺捷," 李晓琳." 刺五加资源的开发利用[J]." 本草中国,2021(5): 108 - 111.
[7] 张天静," 李玲," 沈宝宇," 等." 刺五加特征特性及开发利用[J].园艺与种苗, 2018(11): 34 - 37.
[8] 徐绍娣," 李辉," 张顺捷." 刺五加实生苗生产中存在问题与分析[J]. 中国林副特产, 2017(5): 95 - 96.
[9] 吕艳雪." 刺五加栽培技术[J]." 特种动植物," 2020(2):" 31 - 33.
[10] 沈海龙." 植物组织培养[M]." 北京:" 中国林业出版社, 2005
[11] 唐启义," 冯明光." DPS19.05数据处理系统[M]." 北京:科学出版社, 2007.
[12] 赵丽蒙," 陆秀君," 张丽杰," 等." 卫矛茎段组织培养中不定芽诱导[J]. 东北林业大学学报, 2016, 44(12): 21 - 25.
[13] 张建瑛," 殷东生," 葛文志," 等." 预处理对胡桃楸成熟胚不定芽的诱导[J]. 东北林业大学学报, 2019, 47(2): 21 - 24.